题目内容
10.现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2①根据两反应本质,判断能否设计成原电池A:不能,B:能(填“能”与“不能”)
②根据能设计成原电池的反应选择适宜的材料和试剂设计成一个原电池:负极材料是铜片,电解质溶液是FeCl3溶液;写出正极的电极反应式Fe3++e-=Fe2+,正极发生还原反应(填“氧化”或“还原”).
分析 ①能自发进行的放热的氧化还原反应能设计成原电池;
②失电子发生氧化反应的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的电解质溶液作电解质溶液.
解答 解:①(A)NaOH+HCl=NaCl+H2O不是氧化还原反应,所以不能设计成原电池,(B)2FeCl3+Cu═2FeCl2+CuCl2是自发进行的放热的氧化还原反应,所以能设计成原电池,
故答案为:不能;能;
②在2FeCl3+Cu═2FeCl2+CuCl2反应中,FeCl3被还原,发生还原反应,为正极反应,可用碳棒作正极,电极反应为2Fe3++2e-=2Fe2+,Cu被氧化,为原电池负极反应,电极反应为Cu-2e-=Cu2+,该反应中FeCl3得电子发生还原反应,所以电解质溶液是FeCl3溶液,
故答案为:铜片;FeCl3溶液;Fe3++e-=Fe2+;还原.
点评 本题考查原电池的设计,本题难度不大,注意原电池的组成特点和反应原理,注意电极反应式的书写,为常考查知识.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
18.某充电宝锂离子电池的总反应为:xLi+Li1-xMn2O4$?_{充电}^{放电}$LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH$?_{充电}^{放电}$M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )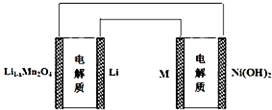

| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-═Li1-xMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,负极的电极反应式:MH+OH--e-═H2O+M |
20.关于吸热反应的说法正确的是( )
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 反应物的总能量比生成物的总能量大 | |
| C. | 氢氧化钠与盐酸的反应属于吸热反应 | |
| D. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
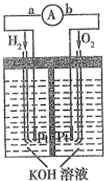 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答: .
.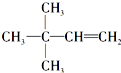 等.
等.
 CH3COOCH2CH3+H2O:反应类型:酯化反应.
CH3COOCH2CH3+H2O:反应类型:酯化反应.