题目内容
【题目】在10L恒容密闭容器中发生反应:X(g)+Y(g)2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是
时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.20 | 0.60 | 0 |
10 | a1 | a2 | 0.25 |
13 | b1 | 0.45 | b2 |
15 | d1 | d2 | 0.30 |
A.前10 min内的平均反应速率v(Y)=2.5×10﹣3mol/(Lmin)
B.保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10﹣3mol/L
C.若起始时只充入0.60molZ(g),反应达平衡时Z(g)的转化率为50%
D.若起始时充入0.60molX(g)、0.10molY(g)和0.50molZ(g),达到平衡前v(正)>v(逆)
【答案】C
【解析】
A.根据题给信息,10分钟时,Z的物质的量为0.25mol,则反应消耗Y为0.125mol,所以前10 min内的平均反应速率v(Y)=![]() =1.25×10﹣3mol/(Lmin),A项错误;
=1.25×10﹣3mol/(Lmin),A项错误;
B.13分钟时,Y为0.45mol,说明反应反应掉Y0.15mol,生成Z为0.3mol,而在15分钟的时候,Z的物质的量仍为0.3mol,说明反应在13分钟的时候达到平衡状态,反应掉X0.15mol,剩余X为0.05mol,浓度为5.0×10﹣3mol/L,该反应是放热反应,升高温度,平衡逆向移动,则反应达平衡时c(X)> 5.0×10﹣3mol/L,B项错误;
C.根据上述分析,该反应的平衡常数K=![]() =4,设平衡时,反应掉的Z的物质的量为xmol,则
=4,设平衡时,反应掉的Z的物质的量为xmol,则 =4,解得x=0.03mol,则反应达平衡时Z(g)的转化率为
=4,解得x=0.03mol,则反应达平衡时Z(g)的转化率为![]() ×100%=50%,C项正确;
×100%=50%,C项正确;
D.根据题给数据,Q=![]() =4.17>4,平衡逆向移动,v(正)<v(逆),D项错误;
=4.17>4,平衡逆向移动,v(正)<v(逆),D项错误;
答案选C。

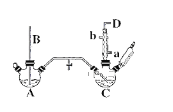
【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
苯 | 78 | 78 | 0.88 |
氯苯 | 112.5 | 132.2 | 1.1 |
邻二氯苯 | 147 | 180.4 | 1.3 |
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式。_______________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______________,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。