题目内容
【题目】某研究小组为了探究一种抗酸药![]() 仅含五种短周期元素
仅含五种短周期元素![]() 的组成和性质,设计并完成了如下实验:
的组成和性质,设计并完成了如下实验:

请回答下列问题:
(1)白色沉淀B中金属元素的离子结构示意图为______,A的电子式为______。
(2)步骤3中生成沉淀C的离子方程式为______。
(3)X的化学式为______,该抗酸药不适合胃溃疡重症患者使用,原因是_____________________。
(4)设计实验方案验证溶液C中的含碳离子______。
【答案】
![]()
![]()
![]()
![]() 和胃酸反应生成二氧化碳气体造成胃穿孔 取少量溶液少许于试管中,加入氯化钙无现象,再加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子
和胃酸反应生成二氧化碳气体造成胃穿孔 取少量溶液少许于试管中,加入氯化钙无现象,再加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子
【解析】
抗酸药X加入过量盐酸生成无色气体A和无色溶液A,溶液A中加入过量氢氧化钠溶液过滤得到白色沉淀B和溶液B,溶液B中加入足量A得到白色沉淀C,沉淀C加入过量氢氧化钠溶液完全溶解,说明沉淀的C为![]() ,则溶液B含有偏铝酸钠,A为CO2,无色溶液C为碳酸氢钠溶液,抗酸药X仅含五种短周期元素,判断沉淀B只能为Mg(OH)2,无色溶液A为AlCl3溶液和MgCl2溶液,抗酸药X加入过量盐酸生成无色气体二氧化碳,说明含有
,则溶液B含有偏铝酸钠,A为CO2,无色溶液C为碳酸氢钠溶液,抗酸药X仅含五种短周期元素,判断沉淀B只能为Mg(OH)2,无色溶液A为AlCl3溶液和MgCl2溶液,抗酸药X加入过量盐酸生成无色气体二氧化碳,说明含有![]() ,
,![]() ,
,![]() ,其中
,其中![]() ,
,![]() ,
,![]() ,则得到剩余部分质量
,则得到剩余部分质量![]() ,依据电荷守恒,物质中含有0.07mol负电荷,则带负电荷的原子团的相对质量为
,依据电荷守恒,物质中含有0.07mol负电荷,则带负电荷的原子团的相对质量为![]() ,判断为OH-,得到化学式为
,判断为OH-,得到化学式为![]() 。
。
(1)上述分析可知白色沉淀B中金属元素为镁元素,镁离子核内有12个质子,核外有两个电子层,第一层2个电子,第二层8个电子,镁离子结构示意图为 ,A为二氧化碳属于共价化合物,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为
,A为二氧化碳属于共价化合物,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为![]() ,
,
故答案为: ;
;![]() ;
;
(2)步骤3中生成沉淀C为![]() ,偏铝酸钠与过量二氧化碳反应的离子方程式为:
,偏铝酸钠与过量二氧化碳反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
(3)上述分析计算可知X为![]() ,X和胃酸反应生成二氧化碳容易造成胃穿孔,引起危险,
,X和胃酸反应生成二氧化碳容易造成胃穿孔,引起危险,
故答案为:![]() ;
;![]() 和胃酸反应生成二氧化碳容易造成胃穿孔;
和胃酸反应生成二氧化碳容易造成胃穿孔;
(4)设计实验方案验证溶液C中的含碳离子为![]() ,取少量溶液少许于试管中,加入氯化钙无现象,说明不含有碳酸根离子,再加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子,
,取少量溶液少许于试管中,加入氯化钙无现象,说明不含有碳酸根离子,再加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子,
故答案为:取少量溶液少许于试管中,加入氯化钙无现象,再加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子。

【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
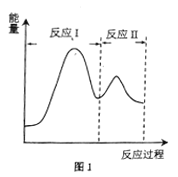
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
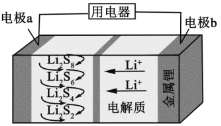
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

【题目】已知:反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
k | 1.67 | 1.11 | 1.00 | 0.60 |
下列有关叙述不正确的是
A. 该反应平衡常数表达式为K=[c(CO2)·c(H2)]/[c(CO)·c(H2O)]
B. 该反应的逆反应是吸热反应
C. 830℃时,向恒容密闭容器中加入CO2 和H2各1mol,当测得CO2 的物质的量为0.4mol时,反应处于平衡状态
D. 若某温度下该反应中各物质的平衡浓度符合关系式:[c(CO2)/3c(CO)]=[c(H2O)/5c(H2)],则该温度是1000 C
【题目】在10L恒容密闭容器中发生反应:X(g)+Y(g)2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是
时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.20 | 0.60 | 0 |
10 | a1 | a2 | 0.25 |
13 | b1 | 0.45 | b2 |
15 | d1 | d2 | 0.30 |
A.前10 min内的平均反应速率v(Y)=2.5×10﹣3mol/(Lmin)
B.保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10﹣3mol/L
C.若起始时只充入0.60molZ(g),反应达平衡时Z(g)的转化率为50%
D.若起始时充入0.60molX(g)、0.10molY(g)和0.50molZ(g),达到平衡前v(正)>v(逆)
【题目】如图所示,常温时将一滴管液体Y一次性全部挤到充满O2的锥形瓶内(装置气密性良好),若锥形瓶内气体的最大物质的量是a mol,久置后其气体的物质的量是b mol,不存在a>b关系的是( )
X | Y |
| |
A | 过量C、Fe碎屑 | 稀HCl | |
B | 过量Na2CO3粉末 | 稀H2SO4 | |
C | 过量Fe、Al碎屑 | 浓H2SO4 | |
D | 过量Cu、CuO粉末 | 浓HNO3 |
A.AB.BC.CD.D