题目内容
镁、铝、铁等金属都在生活和工业中十分常见,请完成下面关于这三种金属的简单计算.
1.一定量的铝铁合金与300mL 2moL?L-1硝酸反应生成33.6L NO(标准状况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol?L-1 NaOH溶液,使铝、铁元素全部转化为沉淀,则所加NaOH溶液的体积是多少?(写出计算过程)
2.在标准状况下进行下列实验:甲、乙、丙各取30.00mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
(1)根据表格中的数据,可计算出合金中镁与铝的物质的量之比为 .
(2)在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体请计算:(写出计算过程)
①滤液中溶质的物质的量
②加入NaOH溶液的体积
3.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)B与A的差值为 mol.
(2)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
1.一定量的铝铁合金与300mL 2moL?L-1硝酸反应生成33.6L NO(标准状况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol?L-1 NaOH溶液,使铝、铁元素全部转化为沉淀,则所加NaOH溶液的体积是多少?(写出计算过程)
2.在标准状况下进行下列实验:甲、乙、丙各取30.00mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
(2)在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体请计算:(写出计算过程)
①滤液中溶质的物质的量
②加入NaOH溶液的体积
3.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)B与A的差值为
(2)B点对应的沉淀的物质的量为
考点:化学方程式的有关计算,氧化还原反应的计算,有关混合物反应的计算
专题:计算题
分析:1.当铝、铁元素全部转化为沉淀时,溶液中仅含NaNO3,氢氧化钠中钠元素与最后溶液中硝酸根物质的量相等,硝酸在反应中部分硝酸根被还原为NO,故n(NaOH)=n(HNO3)总-n(NO),进而计算NaOH溶液的体积;
2.(1)盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,令甲中镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算x、y的值,据此解答;
(2)①在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体,溶液中溶质为NaCl、NaAlO2,根据氢气的体积计算HCl的物质的量,溶液中(NaCl)=n(Cl-),设0.459g合金中含铝的物质的量为xmol,结合(1)中Mg、Al物质的量关系,根据质量列方程计算,由Al元素守恒n(NaAlO2)=n(Al);
②根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),进而计算氢氧化钠的体积;
3.(1)B与A的差值为氢氧化铝的物质的量,计算EF段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
(2)B点对应的沉淀为Fe(OH)3、Al(OH)3,DE段发生反应NH4++OH-=NH3?H2O,根据消耗氢氧化钠溶液计算n(NH4+),根据电子转移守恒计算n[Fe(OH)3]+n[Al(OH)3];
根据氢氧化铝、氢氧化铁总物质的量计算CD段消耗氢氧化钠的体积,进而计算C点体积.
2.(1)盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,令甲中镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算x、y的值,据此解答;
(2)①在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体,溶液中溶质为NaCl、NaAlO2,根据氢气的体积计算HCl的物质的量,溶液中(NaCl)=n(Cl-),设0.459g合金中含铝的物质的量为xmol,结合(1)中Mg、Al物质的量关系,根据质量列方程计算,由Al元素守恒n(NaAlO2)=n(Al);
②根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),进而计算氢氧化钠的体积;
3.(1)B与A的差值为氢氧化铝的物质的量,计算EF段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
(2)B点对应的沉淀为Fe(OH)3、Al(OH)3,DE段发生反应NH4++OH-=NH3?H2O,根据消耗氢氧化钠溶液计算n(NH4+),根据电子转移守恒计算n[Fe(OH)3]+n[Al(OH)3];
根据氢氧化铝、氢氧化铁总物质的量计算CD段消耗氢氧化钠的体积,进而计算C点体积.
解答:
解:1.当铝、铁元素全部转化为沉淀时,溶液中仅含NaNO3,氢氧化钠中钠元素与最后溶液中硝酸根物质的量相等,硝酸在反应中部分硝酸根被还原为NO,故n(NaOH)=n(HNO3)总-n(NO)=0.30L×2moL?L-1-(3.36L÷22.4L/mol)=0.45mol,故需要NaOH溶液的体积=0.45mol÷3mol/L=0.15L=150mL,
答:所加NaOH溶液的体积是150mL.
2.(1)盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,
令甲中镁、铝的物质的量分别为xmol、ymol,根据二者质量可知24x+27y=0.255,根据电子转移守恒有2x+3y=(0.28L÷22.4L/mol)×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为0.005mol:0.005mol=1:1,
故答案为:1:1;
(2)①在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体,溶液中溶质为NaCl、NaAlO2,
盐酸完全反应生成氢气336mL,氢气的物质的量=0.336L÷22.4L/mol=0.015mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,溶液中(NaCl)=n(Cl-)=0.03mol,
设0.459g合金中含铝的物质的量为xmol,由(1)中计算可知,Mg的物质的量也是x mol,则:27x+24x=0.459,解得x=0.009mol,n(NaAlO2)=n(Al)=0.009mol,
答:反应中NaCl为0.03mol,NaAlO2为0.009mol.
②根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2)=0.03mol+0.009mol=0.039mol,故需要氢氧化钠溶液的体积=0.039mol÷1mol/L=0.039L=39mL,
答:加入NaOH溶液的体积为39mL.
3.(1)B与A的差值为氢氧化铝的物质的量,由图可知,EF段消耗的氢氧化钠溶液为36mL-34mL=2mL,故该阶段参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol,
故答案为:0.008;
(2)DE段发生反应NH4++OH-=NH3?H2O,消耗氢氧化钠溶液34mL-31mL=3mL,n(NH4+)=3×10-3L×4mol/L=0.012 mol,N元素由+5价变为-3价,金属都由0价变为+3价,根据电子守恒得出金属的物质的量为0.012mol×8÷3=0.032 mol,即n[Fe(OH)3]+n[Al(OH)3]=0.032mol;
所以CD段消耗NaOH的体积为:0.032mol×3÷4mol/L=0.024L=24mL,故C点体积=31mL-24mL=7mL,
故答案为:0.032;7.
答:所加NaOH溶液的体积是150mL.
2.(1)盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,
令甲中镁、铝的物质的量分别为xmol、ymol,根据二者质量可知24x+27y=0.255,根据电子转移守恒有2x+3y=(0.28L÷22.4L/mol)×2,联立方程解得:x=0.005、y=0.005,故合金中镁与铝的物质的量之比为0.005mol:0.005mol=1:1,
故答案为:1:1;
(2)①在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体,溶液中溶质为NaCl、NaAlO2,
盐酸完全反应生成氢气336mL,氢气的物质的量=0.336L÷22.4L/mol=0.015mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,溶液中(NaCl)=n(Cl-)=0.03mol,
设0.459g合金中含铝的物质的量为xmol,由(1)中计算可知,Mg的物质的量也是x mol,则:27x+24x=0.459,解得x=0.009mol,n(NaAlO2)=n(Al)=0.009mol,
答:反应中NaCl为0.03mol,NaAlO2为0.009mol.
②根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2)=0.03mol+0.009mol=0.039mol,故需要氢氧化钠溶液的体积=0.039mol÷1mol/L=0.039L=39mL,
答:加入NaOH溶液的体积为39mL.
3.(1)B与A的差值为氢氧化铝的物质的量,由图可知,EF段消耗的氢氧化钠溶液为36mL-34mL=2mL,故该阶段参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol,
故答案为:0.008;
(2)DE段发生反应NH4++OH-=NH3?H2O,消耗氢氧化钠溶液34mL-31mL=3mL,n(NH4+)=3×10-3L×4mol/L=0.012 mol,N元素由+5价变为-3价,金属都由0价变为+3价,根据电子守恒得出金属的物质的量为0.012mol×8÷3=0.032 mol,即n[Fe(OH)3]+n[Al(OH)3]=0.032mol;
所以CD段消耗NaOH的体积为:0.032mol×3÷4mol/L=0.024L=24mL,故C点体积=31mL-24mL=7mL,
故答案为:0.032;7.
点评:本题考查混合物计算,属于拼合型题目,题目计算量较大,侧重考查学生分析解决问题能力,(2)根据表中数据关系判断反应的过量问题是关键,(3)中关键明确各阶段发生的反应,注意利用守恒思想解答,题目难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
下列粒子中,中子数相同的是( )
| A、40K和40Ca |
| B、35Cl和35Cl- |
| C、14C和14N |
| D、234U、235U和238U |
下列实验操作中正确的是( )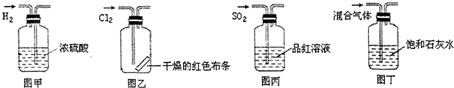

| A、图甲所示,可得到干燥的氢气 |
| B、图乙所示,可以验证氯气的漂白性 |
| C、图丙所示,可以验证SO2的漂白性 |
| D、图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |

 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.