题目内容
常温下,取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略体积的变化),测得混合溶液的pH=9.试回答以下问题:
(1)混合后溶液的pH=9的原因是 (用离子方程式表示);
(2)混合后的溶液中由水电离出的c(OH-)为a,pH=9 的NaOH溶液中由水电离出的c(OH-)为b,则a b(填“>”、“<”或“=”),a:b= .
(3)在混合溶液中c(HA)+c(A-)= mol/L.
(1)混合后溶液的pH=9的原因是
(2)混合后的溶液中由水电离出的c(OH-)为a,pH=9 的NaOH溶液中由水电离出的c(OH-)为b,则a
(3)在混合溶液中c(HA)+c(A-)=
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,
(1)弱酸根离子水解导致NaA溶液呈碱性,写出A-水解的离子方程式;
(2)混合溶液中水电离出的c(OH-)=
、NaOH溶液中由水电离出的c(OH-)=c(H+);
(3)溶液中存在物料守恒,根据物料守恒计算出c(HA)+c(A-).
(1)弱酸根离子水解导致NaA溶液呈碱性,写出A-水解的离子方程式;
(2)混合溶液中水电离出的c(OH-)=
| Kw |
| c(OH-) |
(3)溶液中存在物料守恒,根据物料守恒计算出c(HA)+c(A-).
解答:
解:常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,则HA为弱酸,
(1)A-水解导致NaA溶液呈碱性,水解方程式为:A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
(2)混合溶液中水电离出的c(OH-)为:a=
mol/L=10-5mol/L,NaOH溶液中由水电离出的c(OH-)为:b=c(H+)=10-9mol/L,所以a>b;a:b=10-5mol/L:=10-9mol/L=104:1,
故答案为:>;104:1;
(3)溶液中存在物料守恒:c(HA)+c(A-)=c(Na+)=0.05mol/L,故答案为:0.05.
(1)A-水解导致NaA溶液呈碱性,水解方程式为:A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
(2)混合溶液中水电离出的c(OH-)为:a=
| 1×10-14 |
| 1×10-9 |
故答案为:>;104:1;
(3)溶液中存在物料守恒:c(HA)+c(A-)=c(Na+)=0.05mol/L,故答案为:0.05.
点评:本题考查酸碱混合的定性判断及pH的计算,题目难度中等,难点是碱溶液中水电离出c(OH-)或酸溶液中水电离出的c(H+)计算方法,为易错点,注意明确溶液酸碱性与溶液pH的关系.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、某无色溶液中加入稀盐酸,无明显变化,再加入Ba(NO3)2溶液后,产生白色沉淀,说明原来溶液中含有SO42- |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| D、过量的锌与浓硫酸反应产生的气体是SO2 |
下列结论正确的是.( )
①粒子半径:S2->Cl>S
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④单质氧化性:Cl2>S
⑤酸性:H2SO4>HClO4
⑥分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液.
①粒子半径:S2->Cl>S
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④单质氧化性:Cl2>S
⑤酸性:H2SO4>HClO4
⑥分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液.
| A、① | B、③⑥ | C、②④⑥ | D、①③④ |
有关化工生产原理说法正确的是( )
A、工业上制粗硅:SiO2+C
| ||||
B、海水提镁的主要步骤为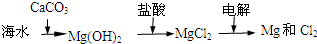 | ||||
C、海水提溴原理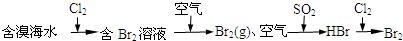 | ||||
| D、硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器 |
一定温度下,在0.1mol/L强电解质NaHB的溶液中,c(H+)>c(OH-),则下列判断中一定正确的是( )
| A、c(Na+)+c(H+)=2c(B2-)+c(OH-) |
| B、c(Na+)=0.1mol/L≥c(B2-) |
| C、c(H+)?c(OH-)=1.0×10-14 |
| D、溶液的pH=1.0 |
下列说法中,在科学上没有错误的是( )
| A、吸带过滤嘴的香烟,对人体无害 |
| B、长期饮用纯净水,有可能引起一些微量元素的缺乏症 |
| C、纯天然物质配成的饮料,不含任何化学物质 |
| D、调味剂和营养剂加得越多越好 |
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能能共存的是( )
| A、NH4+ NO3- CO32- Na+ |
| B、Na+ Ba2+ Mg2+ HCO3- |
| C、NO3- Ca2+ K+H+ |
| D、NO3- K+ AlO2- OH- |
下列叙述正确的是( )
| A、Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 |
| B、在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 |
| C、SO2通入品红中红色褪去,加热后红色恢复 |
| D、将Cl2与SO2按物质的量之比1:1通入紫色石蕊试液,溶液先变红后褪色 |