题目内容
19.下列指定反应的离子方程式正确的是( )| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ | |
| D. | 电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
分析 A.电荷不守恒;
B.醋酸为弱酸,应保留化学式;
C.二者反应生成硫酸钡、硫酸钠和水;
D.氢氧化镁为沉淀,应保留化学式.
解答 解:A.金属钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.用醋酸除去水垢中的碳酸钙,离子方程式:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性,离子方程式:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓,故C正确;
D.电解饱和MgCl2溶液,离子方程式:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
10.下列各组离子能在呈酸性的无色溶液中大量共存的是( )
| A. | Ba2+、Na+、NO3-、MnO4- | B. | Mg2+、Cl-、Al3+、SO42- | ||
| C. | K+、OH-、HCO3-、NO3- | D. | K+、Na+、Fe3+、SO32- |
4.已知向NaNO2溶液中加入酸性KMnO4溶液发生如下反应:2KMnO4+5NaNO2+3H2SO4═2MnSO4+5NaNO3+K2SO4+3H2O有关该反应的下列说法中正确的是( )
| A. | KMnO4作氧化剂 | |
| B. | 该反应不属于离子反应 | |
| C. | 氮元素被还原 | |
| D. | 当生成lmol MnSO4时,转移10 mol电子 |
11.报载一辆满载浓硫酸的槽罐车在路上因车祸翻倒,浓硫酸大量泄露.为了不污染旁边的水源,下列采取的措施适宜的是( )
| A. | 用水冲洗泄露的浓硫酸 | B. | 将熟石灰撒在泄露的浓硫酸上 | ||
| C. | 将氧化钡撒在泄露的浓硫酸上 | D. | 用土将泄露的浓硫酸掩埋 |
8.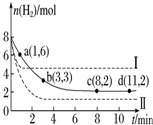 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )| A. | 0.5mol•L-1•min-1. | B. | 0.1mol•L-1•min-1 | ||
| C. | 0 mol•L-1•min-1 | D. | 0.125mol•L-1•min-1 |
9.下列括号中的物质是去除杂质所用的试剂,其中错误的是( )
| A. | CaO中有少量CaCO3(盐酸) | |
| B. | 氢气中含有少量氯化氢(苛性钠溶液) | |
| C. | 硫酸亚铁溶液中含有少量硫酸铜(铁粉) | |
| D. | CO2中有少量CO(灼热的氧化铜) |

 .
.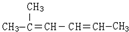 名称为:2-甲基-2,4-己二烯;
名称为:2-甲基-2,4-己二烯; ,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3
,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3