题目内容
12.4℃下,把摩尔质量为Mg•mol-1的可溶性盐RCln(强电解质)Ag溶解在VmL水中,恰好形成该温度下的饱和溶液,密度为ρg•cm-3,下列关系式错误的是( )| A. | 溶质的质量分数ω=$\frac{A}{(A+V)}×100%$ | |
| B. | 溶质的物质的量浓度c=$\frac{1000ρA}{(MA+MV)}mol•{L}^{-1}$ | |
| C. | 1mL该溶液中n(Cl-)=$\frac{nρAV}{M(A+V)}mol$ | |
| D. | 该温度下此盐的溶解度S=$\frac{100A}{V}g$ |
分析 A.溶质的质量分数ω=$\frac{溶质质量}{溶液质量}$×100%;
B.结合c=$\frac{n}{V}$计算;
C.结合n=cV及分子构成计算;
D.饱和溶液中S=$\frac{溶质质量}{溶剂质量}$×100g.
解答 解:A.溶质的质量分数ω=$\frac{溶质质量}{溶液质量}$×100%=$\frac{A}{(A+V)}×100%$,故A正确;
B.物质的物质的量浓度c=$\frac{n}{V}$=$\frac{\frac{A}{M}}{\frac{(A+V)}{ρ}×1{0}^{-3}}$=$\frac{1000ρA}{(MA+MV)}mol•{L}^{-1}$,故B正确;
C.1mL该溶液中n(Cl-)=1×10-3L×$\frac{1000ρA}{(MA+MV)}mol•{L}^{-1}$×n=$\frac{ρAn}{M(A+V)}$,故C错误;
D.饱和溶液中S=$\frac{溶质质量}{溶剂质量}$×100=$\frac{A}{V}$×100g=$\frac{100A}{V}g$,故D正确;
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握质量分数、物质的量关系等为解答的关键,侧重分析与计算能力的考查,注意公式的应用,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
3.活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
(1)2min内,用NO表示该反应的平均速率v(NO)=0.03mol•L-1•min-1.
(2)该反应的化学方程式是C+2NO?N2+CO2.
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是②④.
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
 (4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
①a处通入的物质是CH3OH,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
②b处电极反应式为3O2+12e-+12H+=6H2O;
③电池工作时H+由负极移向正极(填正、负极).
| 活性炭/mol | NO/mol | A/mol | B/mol | |
| 起始状态 | 2.030 | 0.100 | 0 | 0 |
| 2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(2)该反应的化学方程式是C+2NO?N2+CO2.
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是②④.
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
 (4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.①a处通入的物质是CH3OH,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
②b处电极反应式为3O2+12e-+12H+=6H2O;
③电池工作时H+由负极移向正极(填正、负极).
20.下列各组物质间的反应与反应类型不相符的是( )
| A. | 乙烯与溴水(加成反应) | |
| B. | 苯与浓硝酸(取代反应) | |
| C. | 乙醇与乙酸制乙酸乙酯(酯化反应) | |
| D. | 乙醇在铜、银等催化剂存在下与氧气(取代反应) |
17.下列离子方程式书写正确的是( )
| A. | NaHCO3溶液中加入稀HNO3:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| B. | 碳酸钠溶液显碱性:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | 碳酸氢钠溶液中滴入过量澄清石灰水:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O |
11.乙醇在人体内的代谢过程如下:
CH3CH2OH$→_{①}^{乙醇脱氢酶}$CH3CHO$→_{②}^{乙醛脱氢酶}$CH3COOH$→_{③}^{枸橼酸循环}$CO2+H2O
而双硫仑(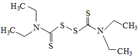 )会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )
)会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )
CH3CH2OH$→_{①}^{乙醇脱氢酶}$CH3CHO$→_{②}^{乙醛脱氢酶}$CH3COOH$→_{③}^{枸橼酸循环}$CO2+H2O
而双硫仑(
 )会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )
)会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )| A. | “双硫仑”分子式为C10H12N2S4,在水中的溶解度较小 | |
| B. | 反应①②均属于氧化反应 | |
| C. | 一个人的酒量大小取决于体内上述两种酶的多少 | |
| D. | 乙醛是对人体有害的物质,含官能团名称为“醛基” |
12.某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
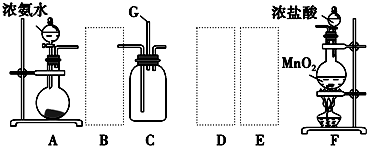
请回答下列问题:
(1)装置F中发生反应的离子方程式:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O.
(2)装置A中的烧瓶内固体可选用ABE(选填以下选项的代号).
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
BⅠ,DⅡ,EⅢ.(均填编号)
(4)从装置C的出气管口处逸出的尾气可能含有污染环境的有毒气体,如何处理?氢氧化钠溶液吸收.原理是(用化学方程式表示):Cl2+2NaOH=NaCl+NaClO+H2O.

| Ⅰ | Ⅱ | Ⅲ | |
| 备选装置 |  | 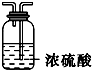 | 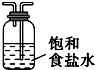 |
(1)装置F中发生反应的离子方程式:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O.
(2)装置A中的烧瓶内固体可选用ABE(选填以下选项的代号).
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
BⅠ,DⅡ,EⅢ.(均填编号)
(4)从装置C的出气管口处逸出的尾气可能含有污染环境的有毒气体,如何处理?氢氧化钠溶液吸收.原理是(用化学方程式表示):Cl2+2NaOH=NaCl+NaClO+H2O.
 .写出甲的一种用途作高能燃料.
.写出甲的一种用途作高能燃料.