题目内容
从下列事实所得出的解释或结论正确的是
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 |
这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 |
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A、A | B、B | C、C | D、D |
考点:反应热和焓变,化学平衡的影响因素
专题:基本概念与基本理论
分析:A、反应能自发进行,则△H-T△S<0,△H>0时△S必须>0;
B、减小气体体积,压强先变大后减小,但比原来大;
C、活泼金属与酸反应放热,开始时反应速率变快;
D、减小气体体积时,即使反应正向移动,反应物的浓度也比原来大.
B、减小气体体积,压强先变大后减小,但比原来大;
C、活泼金属与酸反应放热,开始时反应速率变快;
D、减小气体体积时,即使反应正向移动,反应物的浓度也比原来大.
解答:
解:A、反应能自发进行,则△H-T△S<0,△H>0时△S必须>0,这是一个熵增加的反应,故A正确;
B、压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅,但颜色比原来深,压强也是先变大后减小,但比原来大,故B错误;
C、活泼金属与酸反应放热,开始时反应速率变快,故C正确;
D、减小气体体积时,即使反应正向移动,反应物的浓度也比原来大,故D错误;
故选C.
B、压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅,但颜色比原来深,压强也是先变大后减小,但比原来大,故B错误;
C、活泼金属与酸反应放热,开始时反应速率变快,故C正确;
D、减小气体体积时,即使反应正向移动,反应物的浓度也比原来大,故D错误;
故选C.
点评:本题考查了反应自发进行的条件以及影响化学平衡移动的因素,利用勒夏特列原理解释平衡移动时,注意“减弱这种改变”而不能消除.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物为强碱,Z的原子半径最小.据此判断下列说法不正确的是( )
| A、X是第ⅠA元素,Z是第ⅦA元素 |
| B、X、Y、Z三种元素的最高化合价依次升高 |
| C、Z的最高价氧化物对应的水化物是强酸 |
| D、如果Y的最高价氧化物的水化物难溶于水,则Y一定是Al |
已知H2(g)+Br2(l)=2HBr(g)△H=-72KJ/mol 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如表:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | 200 | a |
| A、404 | B、260 |
| C、230 | D、369 |
下列说法正确的是( )
| A、吸热反应在常温下一定不能发生 |
| B、放热反应的反应速率总是大于吸热反应的反应速率 |
| C、已知C(石墨,s)═C(金刚石,s),△H1>0,说明石墨比金刚石稳定 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
 pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、若x、y都是弱碱,则a的值一定小于9 |
| B、稀释后x溶液中水的电离程度比y溶液中水电离程度小 |
| C、完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
| D、若x、y是一元碱,则等物质的量浓度的y的硝酸盐溶液的pH比x的硝酸盐溶液小 |
进行化学实验必须注意安全,下列说法正确的是( )
| A、可燃性气体在加热或点燃前,必须先检验其纯度 |
| B、浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后抹上碳酸钠溶液 |
| C、配制硫酸溶液时,先在量筒中加入一定量的浓硫酸,再慢慢加入水 |
| D、鉴别食盐和碳酸钠晶体,可用嘴尝药品的味道,有咸味者为食盐 |
下列叙述中,错误的是( )
| A、某自发的化学反应,若△S<0,则该自发反应一定为放热反应 |
| B、利用电化学原理保护金属的一种方法是把被保护金属作为阳极,而另一比其更活泼的金属作为阴极 |
| C、对于反应2NH3(g)?N2(g)+3H2(g),减小体积增大压强,反应物活化分子数及活化分子百分数均不发生改变 |
| D、改变条件,使化学平衡往正向移动,反应物的转化率不一定增大 |
下列基本实验操作中,正确的是( )
A、 气体除杂 气体除杂 |
B、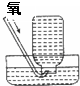 收集氧气 |
C、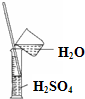 稀释溶液 |
D、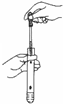 滴加溶液 |