题目内容
(6分)碳是形成化合物种类最多的元素。
(1)CH2=CH-C≡N是制备腈纶的原料,其分子中 键和
键和 键的个数之比为__________(填最简整数比);
键的个数之比为__________(填最简整数比);
(2)乙醇CH3CH2OH与甲醚CH3OCH3的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是____________________;
(3)某元素位于第4周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_______________.
(1)2:1(2)乙醇分子间能形成氢键,甲醚不能,导致乙醇的沸点高于甲醚;(3)3d84s2。
【解析】
试题分析:(1)CH2=CH-C≡N是制备腈纶的原料,其分子中 键和
键和 键的个数之比为6:3=2:1;(2)乙醇CH3CH2OH与甲醚CH3OCH3的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是乙醇分子间能形成氢键,氢键的形成增加了分子之间的相互吸引力,使物质汽化需要消耗较多的能量,而甲醚不能,所以乙醇的沸点高于甲醚;(3)某元素位于第4周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2。
键的个数之比为6:3=2:1;(2)乙醇CH3CH2OH与甲醚CH3OCH3的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是乙醇分子间能形成氢键,氢键的形成增加了分子之间的相互吸引力,使物质汽化需要消耗较多的能量,而甲醚不能,所以乙醇的沸点高于甲醚;(3)某元素位于第4周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2。
考点:考查物质分子内的化学键的类型、物质熔沸点的不同的原因、原子的价层电子排布式的知识。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目



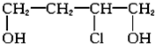 ))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程:
))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程: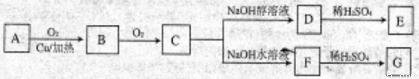
 CO2(g)+H2(g)
CO2(g)+H2(g)
 CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________ (CO)=
(CO)= (CO)=_____;
(CO)=_____; (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”) 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )