题目内容
10.下列有关表示正确的是( )| A. | 过氧化钙(CaO2)的电子式: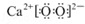 | |
| B. | 某微粒的结构示意简图为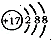 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
分析 A、过氧化钙是离子化合物;
B、微粒的结构示意简图为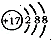 ,则此微粒为Cl-;
,则此微粒为Cl-;
C、碳酸是二元弱酸,在溶液中分步电离;
D、将结构式化简后所得的式子为结构简式,能体现有机物的结构.
解答 解:A、过氧化钙是离子化合物,由钙离子和过氧根构成,故电子式为: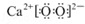 ,故A正确;
,故A正确;
B、微粒的结构示意简图为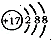 ,则此微粒为Cl-,而氯元素处于第三周期第VIIA族,故B错误;
,则此微粒为Cl-,而氯元素处于第三周期第VIIA族,故B错误;
C、碳酸是二元弱酸,在溶液中分步电离,故正确的电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,故C错误;
D、将结构式化简后所得的式子为结构简式,能体现有机物的结构,故葡萄糖的结构简式为CH2OHCHOHCHOHCHOHCHOHCHO,故D错误.
故选A.
点评 本题考查了物质的电子式、弱电解质的电离和结构简式的书写,难度不大,应注意先判断化合物为共价化合物还是离子化合物,然后再书写电子式.

练习册系列答案
相关题目
15.下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25<t1<t2,则t1℃时纯水中c (H+)= mol•L-1.
mol•L-1.
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至100mL,则稀释后溶液中c (Na+):c (OH-)=100:1
(3)t2℃下,将pH=10的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:2.此溶液中各种离子的浓度由大到小的排列顺序是c(H+)>c(SO42-)>c(Na+)>c(OH-).
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则t1℃时纯水中c (H+)=
 mol•L-1.
mol•L-1.(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至100mL,则稀释后溶液中c (Na+):c (OH-)=100:1
(3)t2℃下,将pH=10的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:2.此溶液中各种离子的浓度由大到小的排列顺序是c(H+)>c(SO42-)>c(Na+)>c(OH-).
1.在溶液中能够大量共存的离子组是( )
| A. | Ca+、Cl-、CO32-、Na+ | B. | Cl-、CO32-、Na+、H+ | ||
| C. | H+、Ba2+、OH-、NO3- | D. | Mg2+、Na+、Cl-、SO42- |
18.正确存放化学药品,是化学实验基本要求之一,下列物质存放错误的是( )
| A. | 金属钠存放于煤油中 | |
| B. | NaOH溶液盛放在带橡皮塞的试剂瓶中 | |
| C. | 新制的氯水保存在棕色玻璃试剂瓶中 | |
| D. | 漂白粉露置在空气中保存 |
5.下列对各组金属性质的比较中,正确的是( )
| A. | 熔点:Li<Na<K | B. | 金属性:Al<Mg | C. | 密度:Na>Mg>Al | D. | 硬度:Mg<K |
20.下列俗名与化学式对应错误的是( )
| A. | 小苏打---NaHCO3 | B. | 明矾---Al2(SO4)3•12H2O | ||
| C. | 铁红---Fe3O4 | D. | 芒硝---Na2SO4•10H2O |
