题目内容
8.下列说法正确的是( )| A. | 引起日本水俣病的重金属是镉 | |
| B. | 引起日本痛痛病的重金属是汞 | |
| C. | 水体富营养化是因为大量含Na+的肥皂水任意排放造成的 | |
| D. | 改善水质最主要的是控制工业废水和生活污水的排放 |
分析 A.引起日本水俣病的重金属是汞离子;
B.痛痛病是由于长期食用含镉污水灌溉的水稻造成的;
C.天然水体中由于过量营养物质(主要是指氮、磷等)的排入,引起各种水生生物、植物异常繁殖和生长,这种现象称作水体富营养化;
D.造成水体污染的主要污染源为工业废水、生活污水.
解答 解:A.水俣病是长期食用含汞的污水灌溉的水稻造成的,而不是含镉的污水,故A错误;
B.引起日本水俣病的重金属是镉,而不是汞离子,故B错误;
C.生活污水中含有丰富的氮、磷,能引起水体富营养化,与钠离子的肥皂水没有关系,故C错误;
D.工业废水、生活污水的排放是造成水体污染的主要污染源,所以防止水体污染和改善水质最根本的措施是控制工业废水和生活污水的排放,故D正确;
故选D.
点评 本题考查了环境污染与治理方法,题目难度不大,明确常见环境污染类型、成因及治理方法为解答关键,试题侧重基础知识的考查,培养了学生的环境保护意识.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列物质中,能使溴水褪色的是( )
| A. | 盐酸 | B. | 二氧化碳 | C. | 二氧化硫 | D. | 甲烷 |
9.下列有关化学用语错误的是 ( )
| A. | 硫离子的核外电子排布式:1s22s22p6 | |
| B. | 碳原子的外围电子轨道表示式: | |
| C. | 碳-14的原子组成符号:${\;}_{6}^{14}$C | |
| D. | Cl-的结构示意图 |
3.2-硝基-l,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成.原理如下:
部分物质的相关性质如下:
制备过程如下:
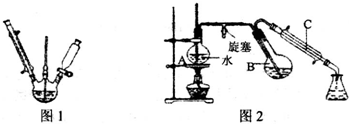
第一步:磺化.称取71.5g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15min(如图1).
第二步:硝化.待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌l 5min.
第三步:蒸馏.将硝化反应混物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏.
请回答下列问题:
(1)实验室中把间苯二酚碾成粉末需要的玻璃仪器是研钵.
(2)磺化步骤中控制温度最合适的范围为(填字母)b.
a.30℃~60℃b.60℃~65℃c.65℃~70℃d.70℃~100℃
(3)硝化步骤中制取“混酸”的具体操作是在锥形瓶中加适量的浓硝酸,在摇荡下缓慢加入一定量的浓硫酸,冷却.
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能 防止防止压强过小产生倒吸;直形冷凝管C中的现象是有桔红色晶体析出,反应一段时间后,停止蒸馏,此时的操作是先打开活塞,再撤去酒精灯(填有关旋塞和酒精灯的操作).
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的abc.
a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应
c.具有一定的挥发性 d.具有较低的熔点
(6)本实验最终获得12.0g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为11.9%.
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
| 2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化.称取71.5g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15min(如图1).
第二步:硝化.待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌l 5min.
第三步:蒸馏.将硝化反应混物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏.

请回答下列问题:
(1)实验室中把间苯二酚碾成粉末需要的玻璃仪器是研钵.
(2)磺化步骤中控制温度最合适的范围为(填字母)b.
a.30℃~60℃b.60℃~65℃c.65℃~70℃d.70℃~100℃
(3)硝化步骤中制取“混酸”的具体操作是在锥形瓶中加适量的浓硝酸,在摇荡下缓慢加入一定量的浓硫酸,冷却.
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能 防止防止压强过小产生倒吸;直形冷凝管C中的现象是有桔红色晶体析出,反应一段时间后,停止蒸馏,此时的操作是先打开活塞,再撤去酒精灯(填有关旋塞和酒精灯的操作).
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的abc.
a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应
c.具有一定的挥发性 d.具有较低的熔点
(6)本实验最终获得12.0g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为11.9%.
13.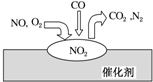 在汽车尾气净化装置里,气体在催化剂表面吸附与释放的过程如图所示.下列说法正确的是( )
在汽车尾气净化装置里,气体在催化剂表面吸附与释放的过程如图所示.下列说法正确的是( )
 在汽车尾气净化装置里,气体在催化剂表面吸附与释放的过程如图所示.下列说法正确的是( )
在汽车尾气净化装置里,气体在催化剂表面吸附与释放的过程如图所示.下列说法正确的是( )| A. | NO是该过程的中间产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分包括CO2和NO | |
| D. | 汽车尾气的主要污染物是CO和NO |
20.三峡电厂发电量可提供相当于每年0.5亿吨原煤的火力发电厂产生的电能,从而有助于控制( )
①白色污染 ②酸雨的形成 ③臭氧空洞扩大 ④温室效应 ⑤三峡库区水质的富营养化.
①白色污染 ②酸雨的形成 ③臭氧空洞扩大 ④温室效应 ⑤三峡库区水质的富营养化.
| A. | ②④ | B. | ③④ | C. | ①②④ | D. | ①②⑤ |
18.碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛.完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.写出该反应的化学方程式4KI+2CuSO4=I2+Cu2I2↓+2K2SO4.
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是H2SO3、KI、Cu2I2.
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg═Cu2HgI4(玫瑰红)+2Cu,产物Cu2HgI4中Cu元素显+1价.当有1molCu2I2参与反应时,转移电子1mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是bd(选填编号)
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.写出该反应的化学方程式4KI+2CuSO4=I2+Cu2I2↓+2K2SO4.
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是H2SO3、KI、Cu2I2.
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg═Cu2HgI4(玫瑰红)+2Cu,产物Cu2HgI4中Cu元素显+1价.当有1molCu2I2参与反应时,转移电子1mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是bd(选填编号)
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
 根据下列图示变化及已知条件填空.
根据下列图示变化及已知条件填空. .元素Z在周期表中的位置是第三周期IVA族
.元素Z在周期表中的位置是第三周期IVA族