题目内容
1.下列现象或事实能够用相同的原理解释的是( )| A. | NaOH、FeSO4在空气中放置变质 | B. | 氯水、AgI密封保存在棕色试剂瓶中 | ||
| C. | 乙烯使溴水和酸性KMnO4溶液褪色 | D. | 常温下浓硝酸不能溶解Al和Au(金) |
分析 A.NaOH在空气中与二氧化碳反应变质,FeSO4在空气中被氧气氧化变质;
B.氯水中的HClO、AgI都见光易分解;
C.乙烯与溴水发生加成反应,与高锰酸钾发生氧化反应;
D.常温下,铝片放入浓硝酸中,生成致密的氧化物阻止反应的进一步发生,Au与浓硝酸不反应.
解答 解:A.NaOH在空气中与二氧化碳反应变质,FeSO4在空气中被氧气氧化变质,变质原理不同,故A不选;
B.氯水中的HClO、AgI都见光易分解,所以都保存在棕色试剂瓶中,原理相同,故B选;
C.乙烯与溴水发生加成反应使溴水褪色,与高锰酸钾发生氧化反应使其褪色,褪色原理不同,故C不选;
D.常温下,铝片放入浓硝酸中,生成致密的氧化物阻止反应的进一步发生,Au与浓硝酸不反应,原理不同,故D不选;
故选B.
点评 本题综合考查元素化合物性质,把握常见物质的性质及发生的化学反应为解答的关键,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
12.下列反应的离子方程式正确的是( )
| A. | 铜放入稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 金属铁溶于稀硫酸中:2Fe+6 H+═2 Fe3++3 H2↑ | |
| D. | 向硫酸溶液中加入氢氧化钡溶液:SO42++Ba2+═BaSO4↓ |
16.以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如图:

已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(2)本流程中产生的CO2和H2,在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为HCOOH(l)+$\frac{1}{2}$O2(g)═CO2(g)+H2O(g);△H=-254.6kJ/m.
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
KMnO4溶液应盛装在酸式滴定管中,滴定过程中发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色通过实验数据计算的该产品纯度为$\frac{980c}{a}×100%$(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是BC
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.

已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(2)本流程中产生的CO2和H2,在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为HCOOH(l)+$\frac{1}{2}$O2(g)═CO2(g)+H2O(g);△H=-254.6kJ/m.
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
6.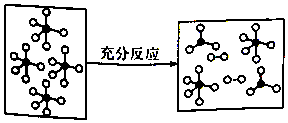 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )| A. | 该反应可表示为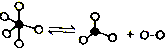 | |
| B. | 可能是PCl5的分解反应 | |
| C. | 反应过程中,一定伴随共价键的断裂与形成 | |
| D. | 该反应的△H>0 |
10.短周期元素X、Y、Z、W、Q在周期表中相对位置如图,其中元素X是地壳中含量最高的元素,下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | 阴离子的还原性:W2-<Q-<Y- | |
| B. | 常温下,X2与W的单质间化合反应不能自发进行 | |
| C. | ZX2是两性氧化物 | |
| D. | Y的氢化物可用来篆刻玻璃 |
2. 碳及其化合物应用广泛.
碳及其化合物应用广泛.
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图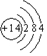 (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
则该温度下反应的平衡常数K=1
(3)相同条件下,向1L恒容密闭容器中,同时注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2,此时v(正 )< v(逆)(填“>”“=”或“<”)
II.已知CO(g)+$\frac{1}{2}$O2 (g)= CO2 (g)△H=-141kJ•mol-1
2H2 (g)+O2(g)= 2H2o (g)△H=-484kJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)=CO2 (g)+2H2O (g)△H=-726kJ•mol-1'
(4)利用CO、H2化合制得液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=+101kJ/mol
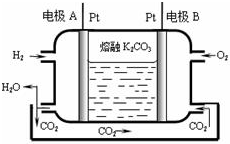
III.一种新型氢氧燃料电池工作原理如图所示
(5)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通入O2的体积为2.24L(标准状况)
 碳及其化合物应用广泛.
碳及其化合物应用广泛.I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图
 (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
(3)相同条件下,向1L恒容密闭容器中,同时注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2,此时v(正 )< v(逆)(填“>”“=”或“<”)
II.已知CO(g)+$\frac{1}{2}$O2 (g)= CO2 (g)△H=-141kJ•mol-1
2H2 (g)+O2(g)= 2H2o (g)△H=-484kJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)=CO2 (g)+2H2O (g)△H=-726kJ•mol-1'
(4)利用CO、H2化合制得液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=+101kJ/mol
III.一种新型氢氧燃料电池工作原理如图所示
(5)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通入O2的体积为2.24L(标准状况)
