题目内容
19.物质的量浓度相同的硫酸铝钾[KA1(S04)2]和Ba(0H)2两种溶液按1:2的体积比混合,下列分析中正确的是( )| A. | 得到沉淀的物质的量最大 | B. | 得到沉淀的质量最大 | ||
| C. | 反应后溶液仍含有Al3+ | D. | 反应后溶液仍含有AlO2- |
分析 物质的量浓度相同的硫酸铝钾[KA1(S04)2]和Ba(0H)2两种溶液按1:2的体积比混合,[KA1(S04)2]和Ba(0H)2的物质的量之比为1:2,二者恰好反应生成偏铝酸钾、硫酸钡沉淀和水,据此进行解答.
解答 解:[KA1(S04)2]和Ba(0H)2的物质的量之比为1:2,硫酸根离子与钡离子的物质的量相等、铝离子与氢氧根离子的物质的量之比为1:4,所以二者恰好反应生成偏铝酸钾、硫酸钡沉淀和水,
A.生成的沉淀完全为硫酸钡,此时生成沉淀的质量最大,铝离子完全转化成氢氧化铝时生成沉淀的物质的量最大,故A正确;
B.钡离子和硫酸根离子完全转化成硫酸钡沉淀,此时生成沉淀的质量最大,故B正确;
C.铝离子完全转化成了偏铝酸钾,反应后溶液中不存在铝离子,故C错误;
D.反应后溶液中含有偏铝酸根离子,故D正确;
故选BD.
点评 本题考查了离子方程式的计算与判断,题目难度不大,正确判断反应后组成为解答关键,注意掌握常见离子的性质及发生反应原理,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
9.既有离子键,又有共价键的化合物是( )
| A. | KBr | B. | NaOH | C. | HBr | D. | N2 |
10.若用X、Y、Z和R分别代表四种元素,而且aXm+、bYn+、cZn-、dRm-四种离子的电子层结构都与S2-相同,则下列关系式正确的是( )
| A. | a-b=m-n | B. | b-d=m-n | C. | c-n=18 | D. | a-m=16 |
4.下列关于卤代烃的叙述中正确的是 ( )
| A. | 所有卤代烃在适当条件下都能发生水解反应 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水且密度比水小的液体 |
11.下列有关电子云和原子轨道的说法中正确的是( )
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s能级原子轨道呈球形,处于该轨道上的电子只能在球壳内运动 | |
| C. | p能级原子轨道呈哑铃状,随着能层的增加,p能级原子轨道也在增多 | |
| D. | p能级原子轨道与s能级原子轨道的平均半径都随能层序数的增大而增大 |
2.下列实验“操作和现象”与“结论”都正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | 向溶液中加入KSCN溶液无明显现象,再加入新制氯水,溶液呈血红色 | 证明原溶液中含有Fe2+ |
| B | 加入AgNO3溶液后生成白色沉淀,加稀盐酸沉淀不溶解 | 可确定有Cl-存在 |
| C | 将某种气体通入酸性KMnO4溶液.溶液褪色 | 说明该气体一定具有漂白性 |
| D | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解 | 证明该溶液中存在AlO2- |
| A. | A | B. | B | C. | C | D. | D |
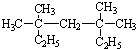 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷; ,B
,B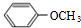 ,C
,C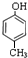 .
.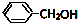 四种有机物能氧化成醛的是AD; 能消去成烯的是BC;
四种有机物能氧化成醛的是AD; 能消去成烯的是BC; 、
、 .
.
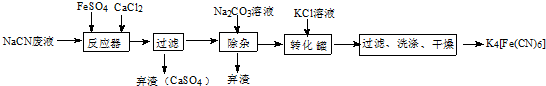
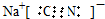 ;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.