题目内容
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
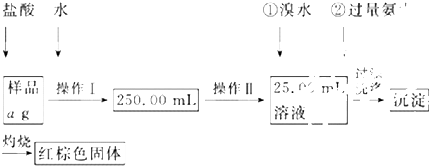
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称),操作Ⅱ必须用到的仪器是 (填编号).
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)实验中为了确定样品中确实有Fe2+的存在,可向试液中加入 检验.
A、NaOH溶液 B、铁粉和KSCN溶液
C、酸性KMnO4溶液 D、氯水和KSCN溶液
(3)请写出加入溴水发生的离子反应方程式 ,加入氨水要过量的原因是 .
(4)检验沉淀是否已经洗涤干净的操作是 .

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)实验中为了确定样品中确实有Fe2+的存在,可向试液中加入
A、NaOH溶液 B、铁粉和KSCN溶液
C、酸性KMnO4溶液 D、氯水和KSCN溶液
(3)请写出加入溴水发生的离子反应方程式
(4)检验沉淀是否已经洗涤干净的操作是
考点:探究物质的组成或测量物质的含量,铁盐和亚铁盐的相互转变
专题:实验探究和数据处理题
分析:(1)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;根据操作II为滴定操作,必须用滴定管;
(2)Fe2+具有还原性,能使酸性KMnO4溶液褪色;Fe2+与KSCN无现象,加入氯水后,氧化Fe2+为Fe3+,溶液变红;
(3)根据Br2具有氧化性,能氧化Fe2+;为了使Fe3+充分沉淀,氨水要过量;
(4)根据取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净.
(2)Fe2+具有还原性,能使酸性KMnO4溶液褪色;Fe2+与KSCN无现象,加入氯水后,氧化Fe2+为Fe3+,溶液变红;
(3)根据Br2具有氧化性,能氧化Fe2+;为了使Fe3+充分沉淀,氨水要过量;
(4)根据取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净.
解答:
解:(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;因操作II为滴定操作,必须用滴定管,
故答案:250mL容量瓶;胶头滴管;D;
(2)Fe2+具有还原性,能使酸性KMnO4溶液褪色;Fe2+与KSCN无现象,加入氯水后,氧化Fe2+为Fe3+,溶液变红,故答案为:CD;
(3)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,故答案为:2Fe2++Br2=2Fe3++2Br-;使Fe3+充分沉淀;
(4)因最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,可证明洗涤干净,故答案为:取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净.
故答案:250mL容量瓶;胶头滴管;D;
(2)Fe2+具有还原性,能使酸性KMnO4溶液褪色;Fe2+与KSCN无现象,加入氯水后,氧化Fe2+为Fe3+,溶液变红,故答案为:CD;
(3)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,故答案为:2Fe2++Br2=2Fe3++2Br-;使Fe3+充分沉淀;
(4)因最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,可证明洗涤干净,故答案为:取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净.
点评:本题主要考查了铁元素的质量分数的测定,同时考查了实验知识,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50.下列说法正确的是( )
| A、25℃时,AgCl的溶解度小于Ag2S的溶解度 |
| B、在25℃的AgNO3溶液中,AgCl的溶解度、Ksp均减小 |
| C、25℃时,在AgCl悬浊液中加入0.1mol?L-1 Na2S溶液,搅拌,生成Ag2S沉淀 |
| D、若取0.144g的AgCl放入100mL水中(忽略溶液体积的变化),则溶液中c(Cl-)=1.0×10-2 mol?L-1 |
下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A、CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol | ||
B、C(s)+
| ||
| C、CH4(g)+2O2(g)=O2(g)+2H2O(l)△H=-890.31 kJ/mol | ||
| D、2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
已知短周期元素A、B、C、D四种元素的核电荷数依次递增,A、C同一主族,B、D也在同一主族,A、B不同周期,C、D同一周期.X、Y均是由A、B、C、D四种元素组成的类型相同的盐,能相互作用,产生有毒气体Z,下列有关说法不正确的是( )
| A、原子半径大小顺序为:r(C)>r(D)>r(B)>r(A) |
| B、元素C能形成两种常见的氧化物,但晶体类型相同 |
| C、X和Y对应的水溶液都显酸性 |
| D、物质CA与水反应可生产气体,CA作氧化剂 |

 利用如图装置收集以下几种气体(如图中烧瓶位置不得移动)
利用如图装置收集以下几种气体(如图中烧瓶位置不得移动)
 (1)在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=
(1)在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=