题目内容
7.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑.该反应中,KNO3 被还原(填“氧化”或“还原”),该反应中的氧化剂S、KNO3;若消耗1mol S,则生成1 mol N2,这些N2的质量是28g,在标准状况下的体积是22.4L.分析 该反应中,硫元素化合价由0价变为-2价,N元素化合价由+5价变为0价,碳元素化合价由0价变为+4价,根据元素化合价变化判断氧化剂和还原剂,根据方程式计算N2的质量和体积,以此解答.
解答 解:反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到-2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,被还原,C元素化合价由0价升高到+4价,则C为还原剂;若消耗1mol S,由方程式可知,生成1mol的N2,氮气的质量为28g,在标准状况下体积为22.4L;
故答案为:还原; S、KNO3;1;28g;22.4L.
点评 本题考查氧化还原反、物质的量的有关计算,把握反应中元素的化合价变化、有关公式为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
15.下列气体为红棕色的是( )
| A. | NO2 | B. | NO | C. | SO2 | D. | N2 |
2.下列离子方程式正确的是( )
| A. | Zn与稀H2SO4反应:Zn+2H+═Zn2++H2↑ | |
| B. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | 碳酸钙溶于盐酸:CO32-+2H+═CO2↑+H2O |
12.2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 青蒿素的分子式是C15H21O4 | |
| B. | 青蒿素可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 双氢青蒿素中含有与H2O2分子中相同的化学键 |
19.下列物质属于电解质且能导电的是( )
| A. | 金属铜 | B. | 碳酸钠晶体 | C. | 硝酸钠溶液 | D. | 熔融氯化钠 |
16.下列物质中,既能与盐酸又能与氢氧化钠溶液反应,且有气体生成的是( )
| A. | Si | B. | SiO2 | C. | Al | D. | Al2O3 |
17.下图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中体现维生素C的还原性(填“氧化性”或“还原性”).
(4)缺铁性贫血患者应补充Fe2+.一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是防止Fe2+被氧化.
| 北京市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中体现维生素C的还原性(填“氧化性”或“还原性”).
(4)缺铁性贫血患者应补充Fe2+.一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是防止Fe2+被氧化.
 2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.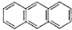 ,平面结构)属于非极性(填“极性”或“非极性”)分子.
,平面结构)属于非极性(填“极性”或“非极性”)分子.
 中①、②、③3个-OH的酸性由强到弱的顺序为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式
中①、②、③3个-OH的酸性由强到弱的顺序为③>①>②;写出B与过量Na2CO3溶液反应的化学方程式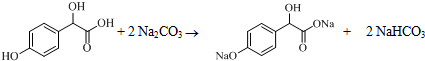 .
.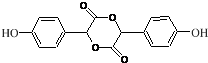 .
.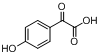 ,写出对应各步反应中依次所需的试剂和反应条件NaOH溶液;Cu、O2、加热;盐酸溶液.
,写出对应各步反应中依次所需的试剂和反应条件NaOH溶液;Cu、O2、加热;盐酸溶液.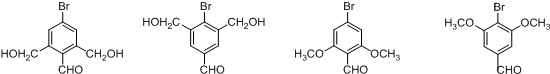 (不考虑立体异构).
(不考虑立体异构).