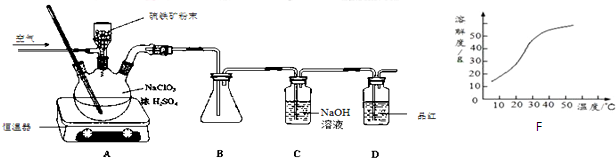
题目内容
13.下列表示对应化学反应的离子方程式正确的是( )| A. | 氯气溶于水:Cl2+H2O═H++Cl-+HClO | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
分析 A.反应生成盐酸和次氯酸;
B.发生氧化还原反应生成S、二氧化硫和水;
C.发生氧化还原反应,遵循电子、电荷守恒;
D.反应生成硅酸和亚硫酸氢根离子.
解答 解:A.氯气溶于水的离子反应为Cl2+H2O═H++Cl-+HClO,故A正确;
B.向稀HNO3中滴加Na2SO3溶液的离子反应为2NO3-+3SO32-+2H+═3SO42-+2NO↑+H2O,故B错误;
C.酸性溶液中KIO3与KI反应生成I2的离子反应为IO3-+5I-+6H+═3I2+3H2O,故C正确;
D.向Na2SiO3溶液中通入过量SO2的离子反应为SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故D错误;
故选AC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.[实验化学]乙酰苯胺为无色晶体,有“退热冰”之称.其制备原理为:
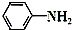 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$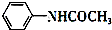 +H2O
+H2O
已知:①苯胺易被氧化; ②苯胺、醋酸和乙酰苯胺的部分物理性质如表:
制备乙酰苯胺的实验步骤如下:
步骤1:在下图1装置的圆底烧瓶中,加入6.0mL苯胺、9.0mL冰醋酸及0.2g锌粉.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,抽滤,洗涤,得到粗产品.
步骤4:通过重结晶提纯粗产品后,获得无色片状晶体,干燥后得目标产品.
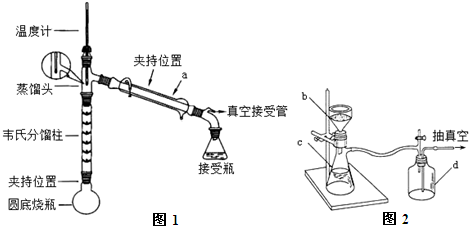
(1)仪器a的名称为冷凝管.
(2)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中控制温度计示数约105℃的原因是乙酸有挥发性,温度过高,乙酸蒸出,降低了反应物的利用率,而温度过低,不能除去反应生成水.
(4)步骤3中,抽滤装置如图2所示,仪器c的名称是吸滤瓶,当过滤的溶液具有强酸性、强碱性或强氧化性时要用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗,停止抽滤时的操作为先旋开安全瓶d上的旋塞恢复常压然后关闭抽气泵.
 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$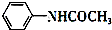 +H2O
+H2O已知:①苯胺易被氧化; ②苯胺、醋酸和乙酰苯胺的部分物理性质如表:
| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
步骤1:在下图1装置的圆底烧瓶中,加入6.0mL苯胺、9.0mL冰醋酸及0.2g锌粉.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,抽滤,洗涤,得到粗产品.
步骤4:通过重结晶提纯粗产品后,获得无色片状晶体,干燥后得目标产品.

(1)仪器a的名称为冷凝管.
(2)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中控制温度计示数约105℃的原因是乙酸有挥发性,温度过高,乙酸蒸出,降低了反应物的利用率,而温度过低,不能除去反应生成水.
(4)步骤3中,抽滤装置如图2所示,仪器c的名称是吸滤瓶,当过滤的溶液具有强酸性、强碱性或强氧化性时要用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗,停止抽滤时的操作为先旋开安全瓶d上的旋塞恢复常压然后关闭抽气泵.
8.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4•7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O.
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)制备FeCO3时,选用的加料方式是c(填字母),原因是避免生成Fe(OH)2沉淀.
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
5.在标准状况下,将VL气体(摩尔质量是Mg/mol)溶于0.1L水中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为( )
| A. | $\frac{V•d}{MV+2240}$mol/L | B. | $\frac{M•V}{2240(V+0.1)d}$mol/L | ||
| C. | $\frac{100V•d•M}{MV+2240}$mol/L | D. | $\frac{1000V•d}{MV+2240}$mol/L |
2.在一定温度下的定容密闭容器中,发生反应:2NO2(g)?N2O4(g).当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
3. 已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
(1)△H3=△H1-3△H2(用△H1、△H2的代数式表示);推测反应Ⅲ是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.
①保持恒温恒容,再充入NO2气体,NO2体积分数变大(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)?2NO2(g);△H2说法正确的是AC.
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2,平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.
 已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1 >K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.
①保持恒温恒容,再充入NO2气体,NO2体积分数变大(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)?2NO2(g);△H2说法正确的是AC.
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2,平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.
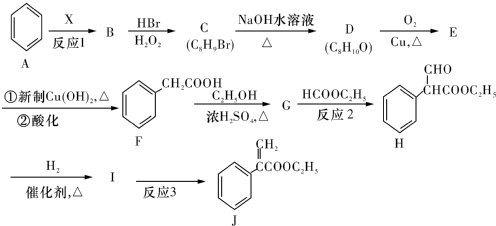
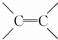 (或碳碳双键).
(或碳碳双键). .
.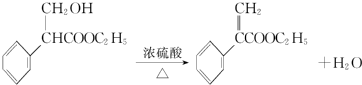 .
.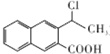 为起始原料制备
为起始原料制备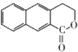 的合成路线
的合成路线 .
.