题目内容
19.次磷酸(H3PO2)是一种具有强还原性的一元弱酸,工业上常利用H3PO2和AgNO3溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中不正确的是( )| A. | H3PO2中磷元素的化合价为+1 | |
| B. | H3PO2的电离方程式为H3PO2?H++H2 PO2- | |
| C. | H3PO2被AgNO3氧化成了H3PO4 | |
| D. | NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐 |
分析 A.根据化合物中化合价的代数和为零计算;
B.一元弱酸部分电离出一个氢离子;
C.H3PO2和AgNO3溶液反应进行化学镀银,此反应中氧化剂与还原剂的物质的量之比为4:1,结合化合价判断产物;
D.H3PO2是一元酸,NaH2PO2是正盐.
解答 解:A.H3PO2中H为+1价,O为-2价,则磷元素的化合价为+1,故A正确;
B.次磷酸是一元弱酸,一元弱酸部分电离出一个氢离子,所以H3PO2的电离方程式为H3PO2?H++H2 PO2-,故B正确;
C.H3PO2中,氢元素为+1价,氧元素为-2价,依据化合价代数和为0,磷化合价为+1价,该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,故C正确;
D.H3PO2是一元酸,NaH2PO2是正盐,NaH2PO4、Na2HPO4均为酸式盐,故D错误.
故选D.
点评 本题考查了元素化合价的判断、弱电解质的电离、氧化还原反应、酸式盐的判断,题目涉及的知识点较多,侧重于考查学生对基础知识的应用能力,题目难度中等.

练习册系列答案
相关题目
9.将 ag 铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加 反应的 HCl 为 0.08mol,放出标准状况下的气体 0.224L.则下列判断中正确的是( )
| A. | 此时溶液中 Fe2+和 Fe3+的物质的量之比为 3:1 | |
| B. | 向溶液中滴入 KSCN 溶液,显血红色 | |
| C. | 无法计算原混合物的质量 | |
| D. | 原混合物中 n(Fe):n(Fe2O3)=2:1 |
10.下列对实验室突发事件的处理,合理的是( )
| A. | 日光灯管破碎,只需收集散落的汞即可 | |
| B. | 金属镁失火,应采用泡沫灭火器灭火 | |
| C. | 钡离子中毒,可以通过服用碳酸钠溶液解毒 | |
| D. | 烧碱溶液溅到皮肤上,应立即用大量的水冲洗 |
7.三氯化磷(PCl3)是一种用于有机合成的重要催化剂.实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示.
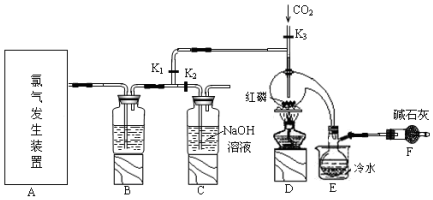
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
请答下面问题:
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.
14.下列各选项中符合条件的同分异构体种类最多的是(均不考虑立体异构)( )
| A. | 异丁烷的二氯代物 | |
| B. | 分子式为C6 H14的有机物 | |
| C. | 甲酸正丙酯属于酯的同分异构体 | |
| D. | 分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物 |
4.有关氯化钠叙述错误的是( )
| A. | 是强电解质 | B. | 固体能导电 | ||
| C. | 电子式为: | D. | 25℃时,溶液的pH=7 |
11.实验现象描述错误的是( )
| A. | 碘单质受热升华:紫色蒸气 | B. | 硫磺在氧气中燃烧:蓝紫色的火焰 | ||
| C. | 铁丝在氯气中燃烧:棕褐色的烟 | D. | 氢气在氯气中燃烧:淡蓝色火焰 |
13.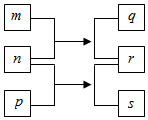 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | Y的氢化物的沸点比Z的氢化物的沸点高 | |
| C. | 通常状况下,X的氢化物可能呈气态、液态或固态 | |
| D. | 由W、X、Y、Z四种元素只能组成一种化合物 |