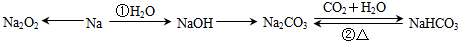题目内容
13.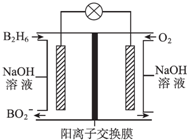 乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示.下列说法中不正确的是( )
乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示.下列说法中不正确的是( )| A. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池工作时,Na+通过阳离子交换膜向右移动 | |
| C. | 转移6mol电子理论上消耗乙硼烷的质量为14g | |
| D. | 消耗1mol B2H6时负极参与反应的n(OH-)为12mol |
分析 A、在碱性环境中,正极上氧气得电子生成OH-;
B、原电池工作时,阳离子向正极移动;
C、根据图示可知B2H6转化为BO2-,根据电子守恒和电荷守恒可得,该极电极反应式为B2H6-12e-+14OH-═2BO2-+10H2O,据此计算,
D、根据电极反应式为B2H6-12e-+14OH-═2BO2-+10H2O来回答.
解答 解:A、在碱性环境中,氧气得电子生成OH-,正极的电极反应式为O2+4e-+2H2O═4OH-,故A正确;
B、原电池工作时,阳离子向正极移动,即Na+通过阳离子交换膜向右移动,故B正确;
C、根据图示可知B2H6转化为BO2-,根据电子守恒和电荷守恒可得,该极电极反应式为B2H6-12e-+14OH-═2BO2-+10H2O,据此可知,转移6mol电子理论上消耗0.5molB2H6,其质量为14g,消耗1molB2H6时负极参与反应的n(OH-)为14mol,故C正确,
D、耗1mol B2H6时负极参与反应的n(OH-)为14mol,故D错误.
故选D.
点评 本题考查原电池原理以及电极反应式的书写知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
3.下列物质分类正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、纯碱、石英均为电解质 | D. | 氯水、水玻璃、氨水均为混合物 |
4.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
1.下列变化需加入还原剂的是( )
| A. | HCO3-→CO2 | B. | MnO4-→Mn2+ | C. | Fe2+→Fe3+ | D. | H+→H2O |
5.三聚氰酸的结构如图所示,下列有关三聚氰酸的说法不正确的是( )
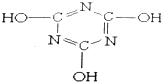

| A. | 分子式为C3H3N303 | B. | 属于共价化合物 | ||
| C. | 分子中只含极性键,不含非极性键 | D. | 该分子中的C原子采取sp3杂化 |
2.用如图表示的一些物质或概念间的从属关系中,正确的是( )
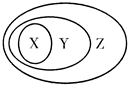

| A. | X是氧化物Y是化合物Z是纯净物 | |
| B. | X是非金属单质Y是非电解质Z是纯净物 | |
| C. | X是金属氧化物Y是碱性氧化物Z氧化物是 | |
| D. | X是置换反应Y是氧化还原反应Z是离子反应 |
3.在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A. | K+ MnO4- Na+ Cl- | B. | K+ Na+ NO3- CO32- | ||
| C. | Na+ H+ NO3- SO42- | D. | Fe3+ Na+ Cl- SO42- |