题目内容
1.室温下,将0.1mol下列物质分别加入蒸馏水制成100mL溶液,所得溶液中阴离子数目的大小顺序是(溶液体积变化忽略不计)( )①Na2O2 ②Na2O ③Na2CO3 ④Na2SO4.
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ①=②>③>④ | D. | ①=②>③=④ |
分析 等物质的量的Na2O2与Na2O分别于水反应生成等物质的量的NaOH,消耗的水的量相同,生成的OH-浓度相同,均约为2mol/L,Na2CO3因水解,使阴离子浓度稍增大,发生CO32-+H2O?HCO3-+OH-,以此解答该题.
解答 解:由①反应为2Na2O2+2H2O=4NaOH+O2↑,②反应为Na2O+H2O=2NaOH溶于水,二者消耗的水的量相同,生成等物质的量的NaOH,故生成的OH-浓度相同,均约为2mol/L,故为①=②;
③中碳酸根水解使得阴离子浓度稍大于④,而④中Na2SO4的浓度为0.1mol/L,
故选C.
点评 本题考查钠的重要化合物以及盐类水解知识,为高频考点,侧重考查学生分析计算能力,正确判断①②溶液中溶质及其物质的量是解本题关键,注意发生的化学反应,题目难度中等.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
11.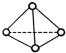 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4是N2的同位素 |
12.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 我国古代文献《天工开物》记载“凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测”是因为KNO3能自燃 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| D. | 运用荧光蛋白可以观测到细胞的活动,荧光蛋白是一种高分子化合物且能发生水解 |
9.下列物质放入水中,能形成溶液的是( )
| A. | 面粉 | B. | 牛奶 | C. | 白糖 | D. | 植物油 |
16.下列物质对应的电子式书写正确的是( )
| A. | NH4Br: | B. | CaCl2: | ||
| C. | Na2O2: | D. | N2:N??N |
6.取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为( )
| A. | 2:1:2 | B. | 2:1:3 | C. | 6:3:2 | D. | 3:7:1 |
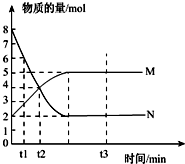 (1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: