题目内容
13.下列说法不正确的是( )| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质的分子内不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | NaCl晶体熔化,需要破坏离子键 |
分析 A、稳定性是化学性质,而氢键是决定物理性质;
B、如稀气体之间不存任何化学键;
C、氯化铵是由非金属元素组成,而氯化铵是共价化合物;
D、氯化钠是离子晶体.
解答 解:A、稳定性是化学性质,而氢键是决定物理性质,而氟化氢稳定是氢氟键的键能大,故A错误;
B、如稀气体之间不存任何化学键,所以构成单质分子的粒子之间不一定存在共价键,故B正确;
C、氯化铵是由非金属元素组成,而氯化铵是离子化合物,所以由非金属元素组成的化合物不一定是共价化合物,故C正确;
D、氯化钠是离子晶体熔化时破坏离子键,故D正确;
故选A.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键、范德华力、化学键的不同及对物质的性质的影响即可解答,难度不大.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
4.常温下,向1L0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中正确的是( )
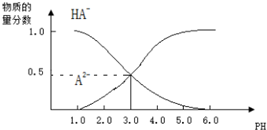

| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | pH=4.0时,图中n(HA-)约为0.0091mol |
1.完全燃烧一定质量的无水乙醇(C2H5OH),放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是( )
| A. | 0.2Q | B. | 10Q | C. | 5Q | D. | 0.1Q |
5.下列各组离子中,在给定条件下能大量共存的是( )
| A. | 在pH=1的溶液中:NH4+、ClO-、Cl- | |
| B. | 有SiO32-存在的溶液中:Na+、SO42-、Cl- | |
| C. | 有NO3-存在的溶液中:H+、Ba2+、Fe2+ | |
| D. | 室温下,水电离的c水(H+)=1.0×10-13mol•L-1溶液中:Na+、S2-、AlO2- |
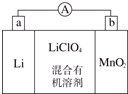 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2. 回答下列问题:
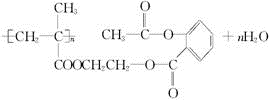
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2. 回答下列问题: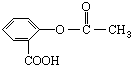 ,它可以接在一种高聚物载体上形成缓释长效药剂.其中的一种结构如下:
,它可以接在一种高聚物载体上形成缓释长效药剂.其中的一种结构如下: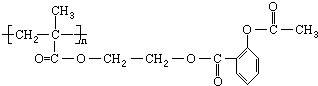
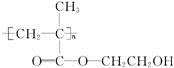 .
.
 .
.