题目内容
1.完全燃烧一定质量的无水乙醇(C2H5OH),放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是( )| A. | 0.2Q | B. | 10Q | C. | 5Q | D. | 0.1Q |
分析 根据CO2与NaOH溶液反应生成碳酸钠和碳酸氢钠,极值法计算出CO2的物质的量,进而计算出乙醇的物质的量,根据乙醇的物质的量和热量的关系求出.
解答 解:n(NaOH)=0.5L×0.8mol/L=0.4mol,则由CO2~2NaOH~Na2CO3,可知,n(CO2)=0.2mol,则n(C2H6O)=$\frac{1}{2}$×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,由CO2~NaOH~NaHCO3可知,n(CO2)=0.4mol,则n(C2H6O)=$\frac{1}{2}$×n(CO2)=0.2mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为5Q,若二氧化碳和氢氧化钠反应生成碳酸氢钠和碳酸钠的化合物,则乙醇的燃烧热在5Q~10Q之间,而题意中是使之生成正盐Na2CO3,
故选C.
点评 本题考查了化学反应极值分析计算,反应燃烧热概念的分析应用,掌握概念和计算方法是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.微量元素摄入不当会导致疾病,下列做法的主要目的与补充微量元素有关的是( )
| A. | 喝咖啡加糖 | B. | 炒菜加味精 | ||
| C. | 加工食品时添加防腐剂 | D. | 炒菜时加碘盐 |
6.某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如表:
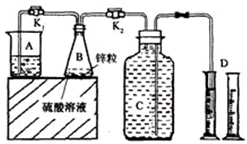
请回答:
(1)关闭K2、打开K1,观察到A中冒出均匀的气泡,说明B反应达到平稳.
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是滴加0.5ml的饱和硫酸铜溶液对生成氢气速率的影响.
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有$\frac{2}{5}$的水时,则V=$\frac{b{V}_{m}}{39}$[与b的代数关系式,气体摩尔体积是Vm(mL•mol-1)].
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为B(填选项).
A.20 B.30C.27 D.40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验3(填实验序号).
(6)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是Zn+2Cu2++2Cl-﹦2CuCl↓+Zn2+.

| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | B反应达到平稳时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到A中冒出均匀的气泡,说明B反应达到平稳.
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是滴加0.5ml的饱和硫酸铜溶液对生成氢气速率的影响.
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有$\frac{2}{5}$的水时,则V=$\frac{b{V}_{m}}{39}$[与b的代数关系式,气体摩尔体积是Vm(mL•mol-1)].
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为B(填选项).
A.20 B.30C.27 D.40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验3(填实验序号).
(6)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是Zn+2Cu2++2Cl-﹦2CuCl↓+Zn2+.
13.下列说法不正确的是( )
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质的分子内不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | NaCl晶体熔化,需要破坏离子键 |
10.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓硫酸,KW不变 | |
| B. | 在硫化钠稀溶液中,c(H+)═c(OH-)-2c(H2S)-c(HS-) | |
| C. | 氯化钠溶液和醋酸铵溶液均显中性,但两溶液中水的电离程度不相同 | |
| D. | pH=1的强酸溶液加水稀释后,溶液中各离子浓度均减小 |
11.下列说法错误的是( )
| A. | 二氧化碳和二氧化硅都属于原子晶体 | |
| B. | 分子晶体的状态变化,只需克服分子间作用力 | |
| C. | 金属晶体通常具有导电、导热性能和良好的延展性 | |
| D. | 离子晶体在熔化状态下能导电 |
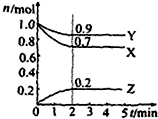 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: