题目内容
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论正确的是
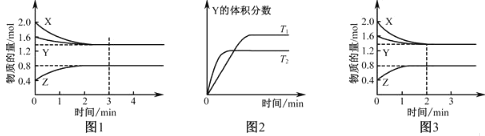
A.反应进行的前3min内,用X表示的反应速率υ(X)=0.3 mol·L-1·min-1
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
【答案】D
【解析】
A. 反应进行的前3min,反应已经达到平衡,平衡时,X的物质的量为1.4mol ,υ(X)= =0.1 mol·L-1·min-1,故A错误;
=0.1 mol·L-1·min-1,故A错误;
B. 由图2知,"先拐平数值大",所以,升高温度Y的体积分数减少,平衡向正反应方向移动,即生成物的浓度增大,反应物的浓度减少,所以平衡常数增大,故B错误;
C. 图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故C错误;
D. 由图1知,前3min内X的物质的量减少量为2.0mol-1.4mol=0.6mol,Y的物质的量减少量为1.6mol-1.4mol=0.2mol, X、Y为反应物;Z的物质的量增加量为0.8mol-0.4mol=0.4mol, Z为生成物,同一化学反应同一时间段内,反应物减少的物质的量和生成物增加的物质的量之比等于化学计量数之比,所以X、Y、Z的计量数之比=3:1:2,所以反应可表示为3X(g)+Y(g)2Z(g),故D正确;答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060