题目内容
【题目】A、B、C是中学化学常见物质(纯净物或水溶液),其转化关系如下(部分反应物或产物未标出;反应条件未标出)。回答下列问题:
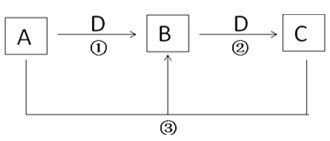
(1)若D为气体,在标况下的密度为1.964g·L-1;A为强碱溶液,其焰色反应为黄色,则反应②的化学方程式为_________________.
(2)若B为白色胶状沉淀,D为强碱溶液.则反应③的离子方程式为___________
(3)若A为黄绿色的气体,D为目前使用量最大的金属单质,则检验B物质中的阳离子时发生的离子方程式为_______________.
(4)若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2.则反应②的离子方程式为_______________________.
(5)若D为O2,要实现上面的转化,A、C分别可以是________________(各填一种,填化学式) .
【答案】Na2CO3+CO2+H2O=2NaHCO3 3AlO2—+Al3++6H2O=4Al(OH)3↓ Fe3++3SCN—=Fe(SCN)3 3Fe2++4H++NO3—=3Fe3++NO↑+2H2O C、 CO2 或NH3、NO或H2S、SO2
【解析】
(1)若D为气体,在标况下的密度为1.964g·L-1,D是摩尔质量是1.964g·L-1×22.4L/mol=44g/mol,所以D是CO2,;A为强碱溶液,其焰色反应为黄色,A是NaOH,根据转化关系,B是Na2CO3、C是NaHCO3,则反应②的化学方程式为Na2CO3+CO2+H2O=2NaHCO3;
(2)若B为白色胶状沉淀,D为强碱溶液,根据转化关系,A是铝盐、B是氢氧化铝、C是偏铝酸盐;反应③是铝盐和偏铝酸盐发生双水解反应生成氢氧化铝,离子方程式为3AlO2—+Al3++6H2O=4Al(OH)3↓;
(3)A为黄绿色的气体,A是氯气, D为目前使用量最大的金属单质,D是铁;则B是氯化铁,用KSCN溶液检验Fe3+,发生的离子方程式为Fe3++3SCN—=Fe(SCN)3;
(4)若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2,则A是铁、D是硝酸、B是硝酸亚铁、C是硝酸铁,则反应②是Fe2+被硝酸氧化为Fe3+,离子方程式为3Fe2++4H++NO3—=3Fe3++NO↑+2H2O;
(5)若D为O2,要实现上面的转化,A、C分别可以是C、 CO2 或NH3、NO或H2S、SO2。

 阅读快车系列答案
阅读快车系列答案