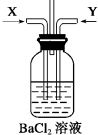
题目内容
18.用双线桥或单线桥标出电子转移的方向和数目,并指出氧化剂还原剂.(1)Zn+2HCl=ZnCl2+H2↑
氧化剂HCl
还原剂Zn
(2)2Fe+3Cl2=2FeCl3
氧化剂Cl2
还原剂Fe.
分析 (1)2HCl+Zn═ZnCl2+H2↑中失电子的Zn元素化合价升高,得电子的H元素化合价降低,转移电子数为2.
(2)该反应中Fe元素化合价由0价变为+3价、Cl元素化合价由0价变为-1价,所以Fe失电子转移给Cl原子,转移电子总数为6.
解答 解:(1)2HCl+Zn═ZnCl2+H2↑中失电子的Zn元素化合价升高,得电子的H元素化合价降低,Zn为还原剂,HCl为氧化剂,化合价降低数目=化合价升高数目=转移的电子数目=2,电子转移情况如下: ,故答案为:
,故答案为: ;HCl;Zn;
;HCl;Zn;
(2)该反应中Fe元素化合价由0价变为+3价为还原剂、Cl元素化合价由0价变为-1价,所以氯气为氧化剂,所以Fe失电子转移给Cl原子,转移电子总数为6,其转移电子方向和数目为 ,故答案为:
,故答案为: ,Cl2;Fe.
,Cl2;Fe.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.有机物 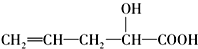 在不同条件下至少可能发生7中不同类型的有机反应,其中分子结构中的-OH可以发生的反应类型有( )
在不同条件下至少可能发生7中不同类型的有机反应,其中分子结构中的-OH可以发生的反应类型有( )
①加成 ②取代 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚.
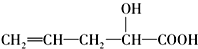 在不同条件下至少可能发生7中不同类型的有机反应,其中分子结构中的-OH可以发生的反应类型有( )
在不同条件下至少可能发生7中不同类型的有机反应,其中分子结构中的-OH可以发生的反应类型有( )①加成 ②取代 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚.
| A. | ①③④ | B. | ③④⑤ | C. | ④⑤⑥⑦ | D. | ②③④⑤⑦ |
6.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
13.有X、Y、Z三种金属,把X投入Z(NO3)2溶液中,X的表面有Z析出;把Y投入XCl2溶液中,Y的表面有X析出.X、Y、Z的金属活动性顺序正确的是( )
| A. | X>Y>Z | B. | Y>Z>X | C. | Z>Y>X | D. | Y>X>Z |
3.下列说法正确的是( )
| A. | 含有离子键和共价键的化合物一定是离子化合物 | |
| B. | 11H2O、12H2O、13H2O互为同位素 | |
| C. | 目前人们已发现的元素种类数目与原子种类数目相同 | |
| D. | 1H的质量数为1,所以氢元素的相对原子质量近似为1 |
10.设反应N2(g)+3H2(g)?2NH3(g)△H<0 的反应速率为v1;反应2NH3(g)?N2(g)+3H2(g)△H>0的反应速率为v2.对于上述反应,当温度降低时,v1和v2的变化情况为( )
| A. | 同时增大 | B. | 同时减小 | C. | v1增大,v2减小 | D. | v1减小,v2增大 |
7.设NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| B. | 42克由C2H4和C5H10组成的混合气体中含共用电子对数目为9NA个 | |
| C. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| D. | 12 g石墨烯(单层石墨)中含有六元环的个数为NA |