题目内容
8.(1)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括BC(选填序号).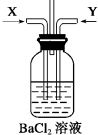
A.通入X气体后产生白色沉淀 B.通入X气体后溶液中无明显现象
C.通入Y气体开始产生沉淀 D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
(2)由此可得到的结论是BDE(选填序号).
A.HNO3的酸性比H2SO4强 B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸 D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液.
分析 (1)铜与浓硫酸反应产生的气体X为二氧化硫,铜与浓硝酸反应产生的大量气体Y为二氧化氮,在试剂瓶中X、Y发生氧化还原反应生成硫酸根离子,再与钡离子结合;
(2)白色沉淀为硫酸钡,可知硝酸可氧化化H2SO3(或SO2),只通入二氧化硫无现象可知盐酸的酸性比H2SO3强,以此来解答.
解答 解:(1)铜与浓硫酸反应产生的气体X为二氧化硫,铜与浓硝酸反应产生的大量气体Y为二氧化氮,
A.通入X气体后无现象,故A错误;
B.通入X气体后溶液中无明显现象,因二氧化硫与氯化钡不反应,故B正确;
C.通入Y气体开始产生沉淀,沉淀为硫酸钡,故C正确;
D.通入Y气体后沉淀不溶解,硫酸钡不溶于水和硝酸,故D错误;
E.通入Y气体后溶液中生成白色沉淀,故E错误;
故答案为:BC;
(2)由上述实验现象可知,只通入二氧化硫无现象可知盐酸的酸性比H2SO3强,再通入二氧化氮生成白色沉淀,则可知HNO3能氧化H2SO3(或SO2),且BaSO4不溶于水也不溶于HNO3溶液,故答案为:BDE.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生氧化还原反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用及实验结论的得出,题目难度不大.

练习册系列答案
相关题目
17.乙醇分子中的化学键如图所示:
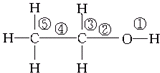
关于乙醇在各种不同反应中断裂键的说法不正确的是( )

关于乙醇在各种不同反应中断裂键的说法不正确的是( )
| A. | 与金属钠反应,键①断裂 | |
| B. | 在Ag或Cu催化作用下和O2反应,键②和键③断裂 | |
| C. | 和浓硫酸共热,在170℃时发生消去反应时键②和⑤断裂 | |
| D. | 乙醇和乙酸在浓硫酸作用下加热时发生反应,键①断裂 |
18.下列关于苯的性质的说法中,正确的是( )
| A. | 苯不溶于水,密度比水大 | |
| B. | 苯在空气中燃烧产生大量的黑烟 | |
| C. | 苯与溴水能发生加成反应生成溴苯 | |
| D. | 苯分子中存在碳碳双键,故能使酸性KMnO4溶液褪色 |
16. 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 属于卤代烃 | C. | 属于芳香化合物 | D. | 属于酚类 |
3.下列关于物质性质的叙述中正确的是( )
| A. | Cl2能与金属活动性顺序表中大多数金属反应 | |
| B. | N2是大气中的主要成分之一,雷雨时可直接转化为NO2 | |
| C. | 硫是一种黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| D. | 浓硫酸可以干燥Cl2,但不能干燥SO2 |
20.下列物质属于分子晶体的是( )
| A. | 熔点是1070℃,易溶于水,水溶液能导电 | |
| B. | 熔点是10.31℃,液态不导电,水溶液能导电 | |
| C. | 能溶于水,熔点812.8℃,沸点是1446℃ | |
| D. | 熔点是97.80℃,质软、导电,密度是0.97g/cm3 |
 .
. .
.