题目内容
【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了
(4)G位于 族 区,价电子排布式为
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是
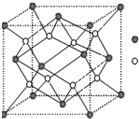
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为 cm
(1) (2分) (2) 3 (1分),纺锤形(1分)
(3)泡利不相容原理(1分) (4) 第ⅦB(1分) d (1分),3d54s2(1分)
(5) sp3(1分), 三角锥形(1分) (6) 焰色反应(1分), 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量。 (2分)
(7)  (2分)
(2分)
解析: 根据元素的性质、原子核外电子排布规律及元素在周期表中的位置可以判断,A是H,B是N,C是Mg,D是P,E是Cl,F是K,G是Mn。
(1)离子化合物中一定含有离子键,所以该化合物是由MH4+和H-形成的离子键,电子式为。
(2)N原子核外电子能量最高的是p电子,在空间有3个方向,原子轨道呈纺锤形。
(3)1个原子轨道最多容纳的电子是2个,且自旋方向相反,这就是泡利原理。3s轨道中的电子自旋方向相同,违反了泡利原理。
(4)Mn属于第四周期第ⅦB,Mn原子最后填入的电子是d轨道的,所以Mn属于d区。锰的原子核外有25个电子,所以就有25种运动方向。
(5)PCl3中中心原子的孤电子对数是1/2(5-3× 1)=1,即价层电子对数是4,所以分子空间构型是三角锥形,采取的是sp3杂化。
1)=1,即价层电子对数是4,所以分子空间构型是三角锥形,采取的是sp3杂化。
(6)检验K元素的最简单方法是焰色反应。之所以会产生焰色反应,是因为当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量。
(7)根据晶胞的结构特点可知,该晶胞中含有的原子个数是2。设原子半径是r,晶胞的边长是x,则有(4r)2=x2+2x2,解得x=![]() 。所以
。所以 ,解得r=
,解得r= 。
。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26.
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
(1)B元素原子核外已成对电子数是未成对电子数的
(2)X、Y、Z的电负性从大到小的顺序为
(3)分子式为A2B、A2E的两种物质中
(4)X的氯化物的熔点比Y的氯化物的熔点
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)3的晶体类型为
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】