题目内容
【化学选修3:物质结构与性质】
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为 ;B、C、D第一电离能由小到大的顺序为 ;(填写元素符号)
(2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A-I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 ;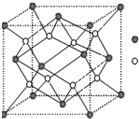
(3)D与G可以形成如图的晶胞,则黑点表示的是 元素(填写元素符号),该元素原子在该晶胞中的配位数为 ;
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为 ,若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,该晶胞中成键原子键角为 ;
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为 如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为 .(阿伏加德罗常数用NA表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为 .
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为
(2)H元素原子的价层电子排布式为

(3)D与G可以形成如图的晶胞,则黑点表示的是
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为
分析:A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,则A原子只能有2个电子层,最外层电子数为4,则A为碳元素;D为周期表中电负性最大的元素,则D为氟元素;H为应用最广泛的金属,则H为Fe;I处于周期表中的第二副族,则I为Zn.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,结合原子序数可知,处于ⅡA族,E为Mg、G为Ca;结合原子序数可知,B为N元素、C为O元素;F与C位于同一主族,F的原子序数小于Ca,则F为S元素,据此解答.
解答:解:A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,则A原子只能有2个电子层,最外层电子数为4,则A为碳元素;D为周期表中电负性最大的元素,则D为氟元素;H为应用最广泛的金属,则H为Fe;I处于周期表中的第二副族,则I为Zn.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,结合原子序数可知,处于ⅡA族,E为Mg、G为Ca;结合原子序数可知,B为N元素、C为O元素;F与C位于同一主族,F的原子序数小于Ca,则F为S元素,
(1)B单质为N2,分子中形成N≡N三键,含有1个σ键、2个π键,σ与π键数目比为1:2;同周期随原子序数增大第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于氧元素,故N、O、F第一电离能由小到大的顺序为O<N<F,
故答案为:1:2;O<N<F;
(2)H为Fe元素,原子的价层电子排布式为3d64s2,Fe3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物,该阴离子为SCN-,又与A-I元素中的某些原子形成的分子互为等电子体,等电子体含有相同的原子数目与价电子总数,该分子为CO2等,价电子总数相同的等电子体空间结构相似,故SCN-与CO2的空间结构相似为直线型,
故答案为:3d64s2;CO2等;直线型;
(3)F与Ca可以形成CaF2,其晶胞中黑色球数目=8×
+6×
=4,白色球数目=8,故黑色球代表Ca元素,由晶胞结构可知,应该F原子周围有4个Ca原子,即F原子配位数为4,则该Ca原子在该晶胞中的配位数为8,
故答案为:Ca;8;
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),则圆圈数目为4,黑色球数目=8×
+6×
=4,晶胞中原子数目为1:1,并将小点和圆圈对应的元素更改为另外两种元素,符合ZnS的立方结构,则这个晶胞化学式为ZnS,
若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,由晶胞结构(类似金刚石结构)可知,每个原子周围连接4个原子,形成正四面体型,该晶胞中成键原子键角为109°28′,
故答案为:ZnS;109°28′;
(5)已知,S单质晶体的原子堆积为ABAB型,为六方最密堆积,晶胞如图: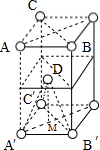 ,
,
D、C′、A′、B′彼此原子相邻,构成正四面体结构,晶胞的高度为该正四面体高的2倍,如果F的原子半径为R,则DA′长为2R,正四面体的高DM,M为正三角形A′B′C′的中心,则A′M的长为
×(2R×
)=
,则DM的长=
=
,故晶胞的高度=2×
=
;
S(△A′B′C′)=
×2R×2R×sin60°=
R2,故底面面积为2
R2,晶胞的体积=2
R2×
=8
R3,晶胞中含有原子数目为1+8×
=2,故原子总体积=2×
×πR3,故晶胞空间利用率=
×100%=74.05%;
如果F单质的摩尔质量为M,晶胞的质量=
,晶胞棱长为a,则S(△A′B′C′)=
×a×a×sin60°=
a2sin60°,故底面面积为a2sin60°,晶胞高度为c,则晶胞体积=ca2sin60°,故晶体密度=
=
=
,
故答案为:74.05%;
;
.
(1)B单质为N2,分子中形成N≡N三键,含有1个σ键、2个π键,σ与π键数目比为1:2;同周期随原子序数增大第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于氧元素,故N、O、F第一电离能由小到大的顺序为O<N<F,
故答案为:1:2;O<N<F;
(2)H为Fe元素,原子的价层电子排布式为3d64s2,Fe3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物,该阴离子为SCN-,又与A-I元素中的某些原子形成的分子互为等电子体,等电子体含有相同的原子数目与价电子总数,该分子为CO2等,价电子总数相同的等电子体空间结构相似,故SCN-与CO2的空间结构相似为直线型,
故答案为:3d64s2;CO2等;直线型;
(3)F与Ca可以形成CaF2,其晶胞中黑色球数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:Ca;8;
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),则圆圈数目为4,黑色球数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,由晶胞结构(类似金刚石结构)可知,每个原子周围连接4个原子,形成正四面体型,该晶胞中成键原子键角为109°28′,
故答案为:ZnS;109°28′;
(5)已知,S单质晶体的原子堆积为ABAB型,为六方最密堆积,晶胞如图:
 ,
,D、C′、A′、B′彼此原子相邻,构成正四面体结构,晶胞的高度为该正四面体高的2倍,如果F的原子半径为R,则DA′长为2R,正四面体的高DM,M为正三角形A′B′C′的中心,则A′M的长为
| 2 |
| 3 |
| ||
| 2 |
2
| ||
| 3 |
(2R)2-(
|
2
| ||
| 3 |
2
| ||
| 3 |
4
| ||
| 3 |
S(△A′B′C′)=
| 1 |
| 2 |
| 3 |
| 3 |
| 3 |
4
| ||
| 3 |
| 2 |
| 1 |
| 8 |
| 4 |
| 3 |
2×
| ||
8
|
如果F单质的摩尔质量为M,晶胞的质量=
| 2M |
| NA |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ca2sin60° |
| ||||
|
| 2M |
| NAca2sin60° |
故答案为:74.05%;
| 2M |
| NAca2sin60° |
4
| ||
| 3 |
点评:本题考查物质结构与性质,涉及核外电子排布、电离能、晶胞结构与计算等,题目计算量大,对学生的空间想象与数学计算有较高的要求,(4)(5)为易错点、难点,理解晶胞结构是关键,难度较大.

练习册系列答案
相关题目
【化学--选修3:物质结构与性质】
已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26.
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
回答下列问题:
(1)B元素原子核外已成对电子数是未成对电子数的 倍.
(2)X、Y、Z的电负性从大到小的顺序为 (用元素符号表示).
(3)分子式为A2B、A2E的两种物质中 更稳定(用化学式表示),原因是 .
(4)X的氯化物的熔点比Y的氯化物的熔点 ,原因是 .
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为 .等电子体指的是原子总数相同.价电子总数相同的分子.离子或基团,据此定义写出离子SCN-的一种等电子体 .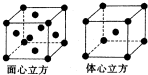
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)3的晶体类型为 .F元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如图所示.在面心立方晶胞中F原子的配位数为 ,体心立方晶胞的密度可表示为 .(F的原子半径为r)
已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26.
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
(1)B元素原子核外已成对电子数是未成对电子数的
(2)X、Y、Z的电负性从大到小的顺序为
(3)分子式为A2B、A2E的两种物质中
(4)X的氯化物的熔点比Y的氯化物的熔点
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为

(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)3的晶体类型为
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】
