题目内容
18.25℃,浓度都是1mol/L的四种正盐溶液,其pH情况如下:| AX | BX | AY | BY |
| pH=7,c(X-)=1mol/L | pH=4 | pH=6 |
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX>HY;若将等体积、等pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH<BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=1mol/L;
在AY溶液中:c(A+)-c(Y-)=c(HY)(用一项表示)=c(OH-)-c(H+)(用两项表示);
(4)A2Z的水解方程式是Z2-+H2O?HZ-+OH-;HZ-+H2O?H2Z+OH-.
分析 AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱;BX的溶液pH=4,BY的溶液pH=6,溶液呈酸性,说明HY为弱酸,BOH为弱碱,
(1)AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐,据此判断溶液酸碱性;
(2)溶液酸性越强,稀释相同倍数时溶液的pH变化越大;溶液碱性越弱,pH变化相等时溶液体积变化越大;
(3)根据电荷守恒、物料守恒进行分析;
(4)A2Z若能够水解,由于AOH为强碱,则H2Z为弱酸,Z2-离子在溶液中分步水解,主要以第一步为主.
解答 解:AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱;BX的溶液pH=4,BY的溶液pH=6,溶液呈酸性,说明HY为弱酸,BOH为弱碱,
(1)AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐,其溶液的pH大于7,
故答案为:>;
(2)HX为强酸,完全电离;HY为弱酸,在溶液中部分电离,存在电离平衡:HY?H++Y-,将等浓度的HX、HY稀释相同的倍数,pH值变化HX大于HY;AOH为强碱,完全电离;BOH为弱碱,部分电离,存在BOH?B++OH-电离平衡,将等浓度的AOH、BOH稀释相同的倍数,pH值变化AOH大于BOH,所以若将等体积、等pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH<BOH,
故答案为:>;<;
(3)HX强酸,BOH为弱碱,在1mol/L的BX溶液中存在电荷守恒:c(B+)+c(H+)=c(OH-)+c(X-),则c(B+)+c(H+)-c(OH-)=c(X-)=1mol/L;
在1mol/L的AY溶液中,根据物料守恒可得:c(A+)=c(Y-)+c(HY),根据电荷守恒可得:c(Y-)+c(OH-)=c(H+)+c(A+),二者结合可得:c(A+)-c(Y-)=c(HY)=c(OH-)-c(H+),
故答案为:1mol/L;c(HY); c(OH-)-c(H+);
(4)A2Z的水解反应分步进行,主要以第一步为主,其Z2-水解的离子方程式为:Z2-+H2O?HZ-+OH-、HZ-+H2O?H2Z+OH-,
故答案为:Z2-+H2O?HZ-+OH-;HZ-+H2O?H2Z+OH-.
点评 本题考查了弱电解质的电离平衡及其影响、离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中的应用方法.

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 对有气体参加的化学反应,通过减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,主要是因为分子运动加剧,碰撞频率提高,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化能增大,从而加快反应速率 |
①苯酚溶液加热变澄清
②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水
③苯酚可与FeCl3反应
④在苯酚溶液中加入浓溴水产生白色沉淀
⑤苯酚钠溶液中通入CO2,出现浑浊
⑥苯酚能与Na2CO3溶液反应放出CO2.
| A. | ②⑤ | B. | ⑤ | C. | ③④⑥ | D. | ③④⑤ |
| A. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中导电粒子的数目增加,导电性增强 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$不变 |
(1)常温下,某氨水的pH=12,则水电离的c(OH-)=1×10-12mol/L.若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度大于(填“大于”、“等于”或“小于”)氨水中水的电离程度.
(2)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡向左移动(填“向正反应方向”、“向逆反应方向”或“不”).
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g)?4NO2(g)+O2(g).下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率v(N2O5)=3×10-3mol•L-1•s-1;降温至T2,反应迸行l000s时测得c(NO2)=4.98mol•L-1,则反应2N2O5(g)?4NO2(g)+O2(g)的△H<0.(填“>”、“=“或“<“).
| t(秒) | 0 | 500 | 1000 |
| N2O5浓度mol•L-1 | 5.00 | 3.50 | 2.42 |
| A. | 物质的量不是1mol | B. | 含的氧原子个数为1mol | ||
| C. | 质子数是2mol | D. | 氧分子个数为1mol |
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 | |
| C. | 酒精灯不慎着火,应立即吹熄 | |
| D. | 眼睛里溅进盐酸,立即用NaOH溶液洗涤眼睛 |


 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程 ;
;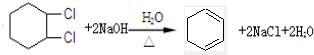 .
.