题目内容
(Ⅰ)已知:氢气的燃烧热为285.8kJ?mol-1;
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)═2NO(g)△H=+180.6kJ?mol-1
H2O(l)═H2O(g)△H=+44.0kJ?mol-1
写出氨气氧化生成一氧化氮气体和水蒸气的热化学方程式 ;
(Ⅱ)已知X(g)+Y(g)═Z(g)+W(g)△H=akJ?mol-1,平衡常数与温度的关系如下:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”,“>”或“=”);
(2)500℃时,在5L密闭容器中充入10mol X、5mol Y、5molZ、5molW,反应进行的方向是 ,反应初始至10min时达到平衡,平衡时 c(W)= mol/L,W在上述10min内的平均反应速率v(W)= mol?L-1?min-1;
(3)能加快该化学反应速率的是 (填正确选项前的字母)
A.恒压充入5mol氩气 B.降低反应温度
C.压缩容器体积增大压强 D.使用高效催化剂.
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)═2NO(g)△H=+180.6kJ?mol-1
H2O(l)═H2O(g)△H=+44.0kJ?mol-1
写出氨气氧化生成一氧化氮气体和水蒸气的热化学方程式
(Ⅱ)已知X(g)+Y(g)═Z(g)+W(g)△H=akJ?mol-1,平衡常数与温度的关系如下:
| 温度/℃ | 300 | 400 | 500 | 750 | 1000 |
| 平衡常数 | 1.8 | 1.6 | 1.0 | 0.8 | 0.6 |
(2)500℃时,在5L密闭容器中充入10mol X、5mol Y、5molZ、5molW,反应进行的方向是
(3)能加快该化学反应速率的是
A.恒压充入5mol氩气 B.降低反应温度
C.压缩容器体积增大压强 D.使用高效催化剂.
考点:用盖斯定律进行有关反应热的计算,反应热和焓变,化学平衡常数的含义,化学反应速率的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:I、由已知热化学方程式根据盖斯定律构造目标热化学方程式,然后求出反应热,再写热化学方程式;
II、(1)根据已知反应的化学方程式和平衡常数的含义书写;根据K随温度的变化趋势判断;
(2)根据该温度下
与K的关系判断;利用三段式求出W的转化的量及平衡时的量,再求出反应速率;
(3)根据影响速率的因素分析.
II、(1)根据已知反应的化学方程式和平衡常数的含义书写;根据K随温度的变化趋势判断;
(2)根据该温度下
| c(Z)?c(W) |
| c(X)?c(Y) |
(3)根据影响速率的因素分析.
解答:
解:I、已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
④H2O(l)═H2O(g)△H=+44.0kJ?mol-1
由盖斯定律可知,①×2-②×2+③×3+④×6得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol;
II、(1)500℃时,在5L密闭容器中充入10mol X、5mol Y、5molZ、5molW,则它们的浓度分别为c(X)=2mol/L,c(Y)=1mol/L,c(Z)=1mol/L,c(X)=1mol/L,则该温度下
=
=0.5<K=1,所以反应未达到平衡状态,即反应向正方向进行,
设X反应的浓度为xmol/L,
X(g)+Y(g)═Z(g)+W(g)
开始(mol/L):2 1 1 1
变化(mol/L):x x x x
平衡(mol/L):2-x 1-x 1+x 1+x
则K=
=1 解得x=0.25,所以平衡时c(W)=1+x=1.25mol/L
v(W)=
=
=0.025mol/(L?min)
故答案为:正方向;1.25;0.025;
(3)A.恒压充入5mol氩气,容器的体积膨胀,反应物的浓度减小,反应速率减小,故A错误;
B.降低反应温度,反应速率减小,故B错误;
C.压缩容器体积增大压强,则各反应物的浓度增大,反应速率加快,故C正确;
D.使用高效催化剂,能增大反应物中活化分子的百分数,使有效碰撞几率增大,反应速率加快,故D正确;
故答案为:CD.
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
④H2O(l)═H2O(g)△H=+44.0kJ?mol-1
由盖斯定律可知,①×2-②×2+③×3+④×6得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol;
II、(1)500℃时,在5L密闭容器中充入10mol X、5mol Y、5molZ、5molW,则它们的浓度分别为c(X)=2mol/L,c(Y)=1mol/L,c(Z)=1mol/L,c(X)=1mol/L,则该温度下
| c(Z)?c(W) |
| c(X)?c(Y) |
| 1×1 |
| 2×1 |
设X反应的浓度为xmol/L,
X(g)+Y(g)═Z(g)+W(g)
开始(mol/L):2 1 1 1
变化(mol/L):x x x x
平衡(mol/L):2-x 1-x 1+x 1+x
则K=
| (1+x)×(1+x) |
| (2-x)(1-x) |
v(W)=
| △c |
| t |
| 0.25mol/L |
| 10min |
故答案为:正方向;1.25;0.025;
(3)A.恒压充入5mol氩气,容器的体积膨胀,反应物的浓度减小,反应速率减小,故A错误;
B.降低反应温度,反应速率减小,故B错误;
C.压缩容器体积增大压强,则各反应物的浓度增大,反应速率加快,故C正确;
D.使用高效催化剂,能增大反应物中活化分子的百分数,使有效碰撞几率增大,反应速率加快,故D正确;
故答案为:CD.
点评:本题考查了盖斯定律的应用及热化学方程式的书写、平衡常数K的有关计算、反应速率以及平衡移动的影响因素等,题目综合较强,难度中等.

练习册系列答案
相关题目
下列金属或氧化物可以完全溶解的是( )
| A、1mol Zn与含1mol HCl的稀盐酸共热 |
| B、1mol Cu与含2mol H2SO4的浓硫酸共热 |
| C、1mol Cu与含4mol HNO3的浓硝酸 |
| D、1mol MnO2与含4mol HCl的浓盐酸共热 |
某高分子化合物的结构简式为 ,该物质可由下列哪组物质为原料直接合成得到( )
,该物质可由下列哪组物质为原料直接合成得到( )
 ,该物质可由下列哪组物质为原料直接合成得到( )
,该物质可由下列哪组物质为原料直接合成得到( )A、 和CH3CH2OH 和CH3CH2OH |
B、 和HOCH2CH2OH 和HOCH2CH2OH |
C、 和CH3CH2OH 和CH3CH2OH |
D、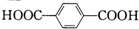 和HOCH2CH2OH 和HOCH2CH2OH |
下列溶液中滴加稀硫酸或氯化镁溶液时,均有白色沉淀生成的是( )
| A、氯化钡 | B、氢氧化钡 |
| C、碳酸钠 | D、氢氧化钾 |
 Ⅰ.已知:温度过高时,WO2(s)转变为WO2(g):
Ⅰ.已知:温度过高时,WO2(s)转变为WO2(g):