题目内容
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)形成化合物种类最多的元素是 (填元素符号).
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式).
(3)①、②、③三种元素按离子半径由大到小的顺序依次为 (填离子符号).
(4)⑥元素形成的具有强氧化性的氢化物电子式是 ,该元素另一种氢化物在常温下与②发生反应的化学方程式为 .
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(1)形成化合物种类最多的元素是
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是
(3)①、②、③三种元素按离子半径由大到小的顺序依次为
(4)⑥元素形成的具有强氧化性的氢化物电子式是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素周期表中的位置知,①②③④⑤⑥⑦⑧⑨分别是Na、K、Mg、Al、C、O、Cl、Br、Ar元素,
(1)形成化合物种类最多的元素是碳元素;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
(4)⑥元素形成的具有强氧化性的氢化物双氧水,该元素另一种氢化物是水,K和水反应生成KOH和氢气.
(1)形成化合物种类最多的元素是碳元素;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
(4)⑥元素形成的具有强氧化性的氢化物双氧水,该元素另一种氢化物是水,K和水反应生成KOH和氢气.
解答:
解:根据元素周期表中的位置知,①②③④⑤⑥⑦⑧⑨分别是Na、K、Mg、Al、C、O、Cl、Br、Ar元素,
(1)形成化合物种类最多的元素是碳元素,有机物中都含有C元素,故答案为:C;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,这三种元素金属性最强的是K,所以碱性最强的是KOH,故答案为:KOH;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小,钾离子电子层数最多,钠离子和镁离子电子层结构相同,但钠离子原子序数小于Mg,所以离子半径大小顺序是K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)⑥元素形成的具有强氧化性的氢化物双氧水,其电子式为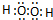 ,该元素另一种氢化物是水,K和水反应生成KOH和氢气,离子方程式为2K+2H2O═2K++2OH-+H2↑,故答案为:
,该元素另一种氢化物是水,K和水反应生成KOH和氢气,离子方程式为2K+2H2O═2K++2OH-+H2↑,故答案为: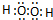 ;2K+2H2O═2K++2OH-+H2↑.
;2K+2H2O═2K++2OH-+H2↑.
(1)形成化合物种类最多的元素是碳元素,有机物中都含有C元素,故答案为:C;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,这三种元素金属性最强的是K,所以碱性最强的是KOH,故答案为:KOH;
(3)离子的电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小,钾离子电子层数最多,钠离子和镁离子电子层结构相同,但钠离子原子序数小于Mg,所以离子半径大小顺序是K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)⑥元素形成的具有强氧化性的氢化物双氧水,其电子式为
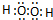 ,该元素另一种氢化物是水,K和水反应生成KOH和氢气,离子方程式为2K+2H2O═2K++2OH-+H2↑,故答案为:
,该元素另一种氢化物是水,K和水反应生成KOH和氢气,离子方程式为2K+2H2O═2K++2OH-+H2↑,故答案为: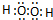 ;2K+2H2O═2K++2OH-+H2↑.
;2K+2H2O═2K++2OH-+H2↑.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及离子半径大小比较、电子式的书写、元素金属性强弱的判断等知识点,根据元素周期律来分析解答,注意双氧水分子电子式的书写,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、向NaHS溶液中通入Cl2:S2-+Cl2=S↓+2Cl- |
| B、向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O=5NO3-+2Mn2++6OH- |
| C、向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
| D、向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
甲乙两种非金属,能说明甲的非金属性一定比乙强的是( )
| A、甲与金属反应时得电子的数目比乙多 |
| B、甲单质的熔沸点比乙的低 |
| C、甲的氧化物对应的水化物酸性比乙强 |
| D、甲能将乙的简单离子从其盐溶液中置换出来 |
依据下列相关实验得出的结论不正确的是( )
| A、将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| B、用激光笔照射稀豆浆,有丁达尔效应,稀豆浆属于胶体 |
| C、向某溶液中加入NaOH溶液并加热,用湿润的红色石蕊试纸放在管口,若试纸变蓝说明原溶液中含NH4+ |
| D、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |