题目内容
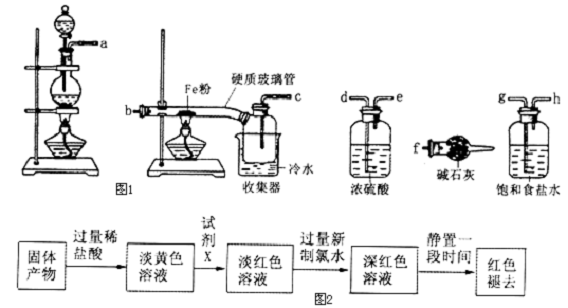
某学习小组的同学对氯气与铁的反应及产物进行了如图1探究:
(1)装置的连接顺序为a→ → → → → → →f.
(2)硬质玻璃管中可观察到的现象是 .
(3)硬质玻璃管与收集器之间没有用导管连接,原因是 .
(4)反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如图2实验:
①试剂X的化学式为 ;
②有同学分析淡黄色溶液中含有Fe2+,你认为 (填“合理’,或“不合理,);固体产物的成分可能为 (填相应的字母);
a.Fe和FeCl3 b.FeCl2和FeCl3 c.Fe、FeCl2和FeCl3 d.Fe和FeCl2
③用离子方程式表示加入新制氯水后溶液红色加深的原因 .
(5)该小组同学对红色褪去的原因进行探究.
①提出假设:
假设1:溶液中无SCN-
假设2:溶液中无Fe3+
假设3: .
②设计方案:请对所提出的假设1进行验证,简要写出实验方案. .
(1)装置的连接顺序为a→
(2)硬质玻璃管中可观察到的现象是
(3)硬质玻璃管与收集器之间没有用导管连接,原因是
(4)反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如图2实验:
①试剂X的化学式为
②有同学分析淡黄色溶液中含有Fe2+,你认为
a.Fe和FeCl3 b.FeCl2和FeCl3 c.Fe、FeCl2和FeCl3 d.Fe和FeCl2
③用离子方程式表示加入新制氯水后溶液红色加深的原因
(5)该小组同学对红色褪去的原因进行探究.
①提出假设:
假设1:溶液中无SCN-
假设2:溶液中无Fe3+
假设3:
②设计方案:请对所提出的假设1进行验证,简要写出实验方案.

考点:性质实验方案的设计
专题:
分析:(1)实验目的是探究氯气与铁的反应及产物,根据先制取纯净、干燥氯气、然后让氯气与铁反应生成氯化铁,最后需要完全吸收装置的顺序连接装置;
(2)铁与氯气反应生成氯化铁,会出现棕黄色的盐;
(3)导管较细,生成的氯化铁固体容易堵塞导管;
(4)①根据检验铁离子的常用方法解答;
②根据加入氯水后混合液红色加深可知,原固体为铁和氯化亚铁的混合物,则淡黄色溶液中含有亚铁离子;
③氯水具有强氧化性,将亚铁离子氧化成铁离子,铁离子浓度增大,溶液红色加深;
(5)①根据假设1、假设2判断假设3的内容;
②根据假设1的内容设计检验方案,写出检验方法.
(2)铁与氯气反应生成氯化铁,会出现棕黄色的盐;
(3)导管较细,生成的氯化铁固体容易堵塞导管;
(4)①根据检验铁离子的常用方法解答;
②根据加入氯水后混合液红色加深可知,原固体为铁和氯化亚铁的混合物,则淡黄色溶液中含有亚铁离子;
③氯水具有强氧化性,将亚铁离子氧化成铁离子,铁离子浓度增大,溶液红色加深;
(5)①根据假设1、假设2判断假设3的内容;
②根据假设1的内容设计检验方案,写出检验方法.
解答:
解:(1)浓盐酸具有挥发性,则制取的氯气中混有氯化氢,需要用饱和食盐水除去杂质HCl,然后用浓硫酸干燥氯气,将干燥的氯气通入盛有铁粉的大试管中,让氯气与铁反应,氯气有毒,需要用碱石灰吸收,所以装置连接顺序为:a→g→h→d→e→b→c→f,
故答案为:g、h、d、e、b、c;
(2)氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,反应方程式为:2Fe+3Cl2
2FeCl3,硬质玻璃管中有棕黄色的烟生成,
故答案为:有棕黄色的烟生成;
(3)生成的氯化铁晶体容易堵塞导管,所以硬质玻璃管与收集器之间没有用导管连接,而是直接与收集器连接,
故答案为:防止堵塞;
(4)①该操作的目的是检验反应产物,可以通过具有铁离子的方法完成,所以加入的试剂X为硫氰化钾溶液,
故答案为:KSCN;
②根据图2可知,先加入硫氰化钾溶液后溶液变红,加入氯水后红色加深,则原固体混合物为Fe和氯化铁,铁与铁离子反应生成亚铁离子,则淡黄色溶液中含有Fe2+,即该分析合理,固体混合物可能为Fe和FeCl3,
故答案为:合理;a;
③氯水将亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,溶液中铁离子浓度增大,根据反应Fe3++3SCN-=Fe(SCN)3可知,生成的硫氰化铁浓度最大,所以溶液红色加深,
故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3;
(5)①假设1:溶液中无SCN-假设2:溶液中无Fe3+,则假设3为:溶液中同时无Fe3+和SCN-,
故答案为:溶液中同时无Fe3+和SCN-;
②假设1为“溶液中无SCN-”,可以向溶液中滴入硫氰化钾溶液,如果溶液变红,则说明假设1成立,操作方法为:取少量褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则假设1成立,
故答案为:取少量褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则假设1成立.
故答案为:g、h、d、e、b、c;
(2)氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,反应方程式为:2Fe+3Cl2
| ||
故答案为:有棕黄色的烟生成;
(3)生成的氯化铁晶体容易堵塞导管,所以硬质玻璃管与收集器之间没有用导管连接,而是直接与收集器连接,
故答案为:防止堵塞;
(4)①该操作的目的是检验反应产物,可以通过具有铁离子的方法完成,所以加入的试剂X为硫氰化钾溶液,
故答案为:KSCN;
②根据图2可知,先加入硫氰化钾溶液后溶液变红,加入氯水后红色加深,则原固体混合物为Fe和氯化铁,铁与铁离子反应生成亚铁离子,则淡黄色溶液中含有Fe2+,即该分析合理,固体混合物可能为Fe和FeCl3,
故答案为:合理;a;
③氯水将亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,溶液中铁离子浓度增大,根据反应Fe3++3SCN-=Fe(SCN)3可知,生成的硫氰化铁浓度最大,所以溶液红色加深,
故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3;
(5)①假设1:溶液中无SCN-假设2:溶液中无Fe3+,则假设3为:溶液中同时无Fe3+和SCN-,
故答案为:溶液中同时无Fe3+和SCN-;
②假设1为“溶液中无SCN-”,可以向溶液中滴入硫氰化钾溶液,如果溶液变红,则说明假设1成立,操作方法为:取少量褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则假设1成立,
故答案为:取少量褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则假设1成立.
点评:本题通过探究氯气与铁反应,考查了物质性质实验方案的设计方法,题目难度稍大,注意掌握氯气与铁反应的现象、反应原理,明确物质性质实验方案的设计原则,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
下列变化过程中,共价键被破坏的是( )
| A、烧碱固体融化 |
| B、氯化氢气体溶于水 |
| C、干冰气化 |
| D、碘溶于酒精 |
下列说法正确的是( )
| A、向2.0mL浓度均为0.lmol/L的KCl、KI混合溶液中滴加l~2滴0.01mol/LAgNO3溶液.振荡,沉淀呈黄色,说明AgCl的溶解度比AgI的溶解度小 |
| B、分别在Na2CO3和NaHCO3两种物质的溶液中,加入少量澄清石灰水,能用来鉴别这两种白色固体 |
| C、向0.1mol/L FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性 |
| D、向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )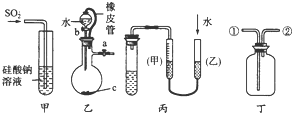

| A、甲装置:可用来证明硫的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法能检查此装置的气密性 |
| D、丁装置:可在瓶中先装入某种液体收集NO气体 |
 某兴趣小组设计研究铜和稀硝酸反应速率[v (NO)]的实验.试回答下列问题:
某兴趣小组设计研究铜和稀硝酸反应速率[v (NO)]的实验.试回答下列问题: