题目内容
15.图1是氮元素在煤粉使用过程中的转化关系: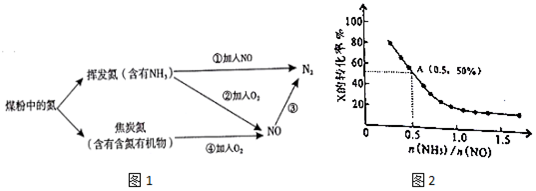
(1)③中加入的物质可以是bd(填标号).
a.空气 b.CO c.KNO3 d.NH3
已知:N2(g)+O2(g)═2NO(g)△H=a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=b kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=d kJ•mol-1
上面转化关系反应后恢复至常温常压,根据以上信息写出③中你所选物质参与反应的热化学方程
式4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H=(3c-3a-2b)kJ•mol-1(如果所选物质不只一种,则只要写出其中一个热化学方程式即可).
(2)将烟气中的氮氧化物(NOx)转化为无害物质,这个过程称为脱硝.下面反应为处理方法之一:
4NH3(g)+4NO(g)+O2(g)$\stackrel{催化剂}{?}$4N2(g)+6H2O(g)△H=-1625.5kJ•mol-1
①若反应生成1molN2,则反应中转移的电子数为3mol.
②使上述反应速率增大且平衡向右移动的措施是增大反应物浓度.
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率.350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如图2所示,则X是NH3(填化学式).在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,该反应的平衡常数K=0.09(保留二位小数).当$\frac{n(N{H}_{3})}{n(NO)}$>1.0 时,烟气中NO浓度反而增大,主要原因是4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O(用化学方程式表示).
④若上述反应在与外界绝热的容器中进行,氨氮比由0.5增加到1.0时,在此过程中该反应的平衡常数减小(填“增大”、“减小”或“不变”).
分析 (1)由图表可知,氮由+2价变成0价,应加还原剂;已知:N2(g)+O2(g)═2NO(g)△H=a kJ•mol-1 …①;N2(g)+3H2(g)═2NH3(g)△H=b kJ•mol-1…②;2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1…③;而①的反应为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l),所以依据盖斯定律计算得到△H=3③-3①-2②;
(2)①反应中生成4mol氮气电子转移总数为12mol;
②反应为气体体积增大的放热反应,结合影响化学反应速率和化学平衡的因素和平衡移动原理分析使上述反应速率增大且平衡向右移动的措施;
③氨气的物质的量越大,氨气的转化率越小;平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,根据氨气与氧气的反应分析;
④氨氮比增大,即氨气的浓度增大,平衡正向移动,上述反应在与外界绝热的容器中进行放出热量增大会导致平衡逆向进行;
解答 解:(1)氮由+2价变成0价,应加还原剂,CO和氨气,故选bd,
已知:N2(g)+O2(g)═2NO(g)△H=a kJ•mol-1 …①;N2(g)+3H2(g)═2NH3(g)△H=b kJ•mol-1…②;2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1…③;而①的反应为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l),所以△H=3③-3①-2②,则△H=(3c-3a-2b) kJ•mol-1,所以热化学方程式为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=(3c-3a-2b) kJ•mol-1,故答案为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=(3c-3a-2b) kJ•mol-1;
故答案为:bd;4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H=( 3c-3a-2b) kJ•mol-1;
(2)①4NH3(g)+4NO(g)+O2(g)$\stackrel{催化剂}{?}$4N2(g)+6H2O(g)△H=-1625.5kJ•mol-1,反应中氨气失电子做还原剂,一氧化氮和氧气得到电子做氧化剂,反应中生成4mol氮气电子转移总数为12mol,若反应生成1molN2,则反应中转移的电子数为3mol,
故答案为:3;
②反应为气体体积增大的放热反应,增大反应物浓度增大反应速率,平衡正向进行,温度只有降低温度平衡正向进行,但反应速率减小,减小压强速率减小.平衡正向进行,所以使上述反应速率增大且平衡向右移动的措施是增大反应物浓度,
故答案为:增大反应物浓度;
③氨氮比[$\frac{n(N{H}_{3})}{n(NO)}$]越大,则氨气的物质的量越大,氨气的转化率越小,由图可知,随着氨气的浓度的增大,X的转化率减小,所以X为NH3;
在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,氨气物质的量为0.5×8mol=4mol,氨气转化率为50%,
4NH3(g)+4NO(g)+O2(g)$\stackrel{催化剂}{?}$4N2(g)+6H2O(g)
起始量(mol/L) 2 4 1.75 0 0
变化量(mol/L) 2×50%=1 1 0.25 1 1.5
平衡量(mol/L) 1 3 1.5 1 1.5
K=$\frac{1.{5}^{6}×{1}^{4}}{{1}^{4}×{3}^{4}×1.5}$=0.09
当$\frac{n(N{H}_{3})}{n(NO)}$>1.0时,氨气与氧气的反应生成NO,所以烟气中NO浓度增大,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NH3;0.09;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
④若上述反应在与外界绝热的容器中进行,氨氮比增大,即氨气的浓度增大,平衡正向移动过程中放出热量,会导致平衡逆向进行,所以氨氮比由0.5增加到1.0时,脱硝主要反应的平衡常数减小,
故答案为:减小;
点评 本题考查了热化学方程式和盖斯定律计算、氧化还原反应电子转移、化学平衡常数计算、图象分析判断等知识点,掌握基础是解题关键,题目难度中等.

| A. | 加入2mL0.1mol•L-1盐酸 | B. | 加入2mL0.1mol•L-1氢氧化钡溶液 | ||
| C. | 加入2mL0.1mol•L-1硫酸铜溶液 | D. | 加入2mL0.1mol•L-1氨水 |
| A. | 原子半径:Z>R>Y | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | Y、Z、R三种元素组成的化合物水溶液一定显中性 | |
| D. | X2W6分子中各原子均满足8电子结构 |
| A. | 体积分数为75%的酒精溶液会使细菌蛋白质变性 | |
| B. | 1 mol甲烷和1 mol氯气在光照条件下充分反应,生成的CH3Cl少于1 mol | |
| C. | 除去乙酸乙酯中少量的乙酸:用饱和氢氧化钠溶液洗涤,并分液、干燥、蒸馏 | |
| D. | 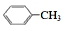 的一溴代物和 的一溴代物和 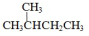 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
| A. | 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用烧杯加热分解Al(OH)3固体 | |
| D. | 用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液 |
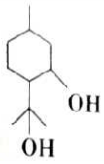 孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )
孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )| A. | 孟二醇与乙醇属于同系物 | |
| B. | 常温常压下,1mol孟二醇与足量的钠反应可生成22.4LH2 | |
| C. | W的两种水解产物均可与NaHCO3溶液反应放出CO2 | |
| D. | W的结构有32种(不含立体异构) |
| A. | 乙烷与氯气混合光照 | |
| B. | 石油裂解制丙烯 | |
| C. | 乙醇与乙酸反应制乙酸乙酯 | |
| D. | 苯与浓硝酸及浓硫酸混合加热到55℃ |
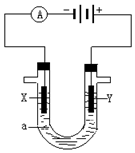 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.
人们习惯上把电解饱和食盐水的工业叫做氯碱工业.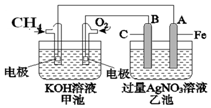 如图是一个化学过程的示意图.请回答下列问题:
如图是一个化学过程的示意图.请回答下列问题: