题目内容
9. 如图是一个化学过程的示意图.请回答下列问题:
如图是一个化学过程的示意图.请回答下列问题:(1)甲池是原电池装置(填“原电池”或“电解池”),B(石墨)电极的名称 是阳极.
(2)写出电极反应式:
通入CH4的电极CH4+10OH--8e-═CO32-+7H2O;A(Fe)电极Ag++e-═Ag.
(3)甲池中反应的离子方程式为CH4+2O2+2OH-═CO32-+3H2O.
(4)乙池中反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(5)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中 A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为280mL(标准状况下);
②乙池中所得溶液的pH=1.
分析 (1)根据方程式及燃料电池的特点判断甲装置;根据甲装置判断乙装置;B(石墨)与原电池的正极相连;
(2)通入CH4的电极是原电池的负极发生氧化反应;A(Fe)电极是电解池的阴极银离子发生还原反应;
(3)甲池中反应的离子方程式为CH4+2O2+2OH-═CO32-+3H2O;
(4)乙池相当于惰性电极电解硝酸银溶液;
(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量=$\frac{5.40g}{108g/mol}$×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积=$\frac{0.05mol}{4}×22.4L/mol$=280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,根据c=$\frac{n}{V}$进行计算.
解答 解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池,
B(石墨)与原电池的正极相连,所以电极的名称是阳极,故答案为:原电池;阳极;
(2)通入CH4的电极是原电池的负极发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O;A(Fe)电极是电解池的阴极银离子发生还原反应,电极反应式为:Ag++e-═Ag,故答案为:CH4+10OH--8e-═CO32-+7H2O;Ag++e-═Ag;
(3)甲池中反应的离子方程式为CH4+2O2+2OH-═CO32-+3H2O,故答案为:CH4+2O2+2OH-═CO32-+3H2O;
(4)乙池相当于惰性电极电解硝酸银溶液,化学方程式为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量=$\frac{5.40g}{108g/mol}$×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积=$\frac{0.05mol}{4}×22.4L/mol$=280mL,故答案为:280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,c=$\frac{n}{V}$=$\frac{0.05mol}{0.5L}$=0.1mol/L,所以PH=1,故答案为:1.
点评 本题考查了原电池和电解池原理,根据得失电子确定正负极、阴阳极,再结合各个电极上发生的反应来分析解答,注意守恒思想的运用,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | BaCl2溶液与Na2CO3溶液加足量稀醋酸 | |
| B. | Ba(OH)2溶液与KNO3溶液加足量H2SO4 | |
| C. | AgNO3溶液与Na2CO3溶液加足量稀硝酸 | |
| D. | Ca(OH)2溶液与FeCl3溶液加足量稀硝酸 |
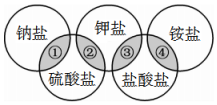 下列各项中的物质,能满足图中阴影部分关系的是( )
下列各项中的物质,能满足图中阴影部分关系的是( )| 物质 选项 | ① | ② | ③ | ④ |
| A | NaCl | KCl | K2SO4 | NH4Cl |
| B | Na2SO4 | K2SO4 | KCl | NH4Cl |
| C | NaCl | KCl | NH4Cl | K2SO4 |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 二氧化硅在地壳中含量丰富,广泛用于制造水泥、玻璃、陶瓷等 | |
| B. | 硅酸钠在建筑工业上常用作黏合剂和木材防火剂 | |
| C. | 碳化硅的结构与金刚石相似,硬度很大常用做砂轮和砂纸 | |
| D. | 硅是良好的半导体材料故用作光导纤维 |
| A. | 硅可用于制造电脑芯片 | B. | 浓H2SO4可用做干燥剂 | ||
| C. | 碳酸氢钠可用于食品的发酵 | D. | 少量金属钠保存在酒精中 |

 如图所示甲、乙为相互串联的两电解池.试回答:
如图所示甲、乙为相互串联的两电解池.试回答: