题目内容
5.下列气体中,既能用浓硫酸也能用固体NaOH干燥的是( )| A. | N2 | B. | SO2 | C. | NH3 | D. | Cl2 |
分析 能用浓硫酸和NaOH干燥,说明该气体不和浓硫酸、NaOH反应,浓硫酸不能干燥碱性气体、部分还原性气体,氢氧化钠不能干燥酸性气体、不能干燥和它反应的部分单质.
解答 解:A.氮气属于中性气体,和浓硫酸、NaOH都不反应,所以符合条件,故A选;
B.二氧化硫属于酸性氧化物,能和NaOH反应生成钠盐,所以不能用NaOH干燥,故B不选;
C.氨气属于碱性气体,能和浓硫酸反应生成铵盐,所以不能用浓硫酸干燥,故C不选;
D.氯气能和NaOH反应生成盐,所以氯气不能用NaOH干燥,故D不选;
故选A.
点评 本题以气体干燥为载体考查元素化合物性质,明确物质性质及物质之间的反应是解本题关键,注意:浓硫酸还不能干燥硫化氢等还原性气体,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L F2所含原子数为0.1NA | |
| B. | 4.4gCO2中氧分子的个数为0.1NA | |
| C. | 78g Na2O2固体中Na+的个数目为NA | |
| D. | 2.3gNa完全燃烧后失去电子的个数为0.1NA |
16.下列各项表述正确的是( )
| A. | 水分子的结构式是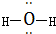 | |
| B. | NaCl的电子式为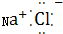 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为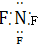 |
10.设想你采集了某星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到下列结果:
按照元素性质的周期性递变规律,试确定以上十种元素的相对位置,将其余五种元素填入下表:
| 单质 | A | B | C | D | E | F | G | H | I | J |
| 熔点(℃ | -150 | 550 | 160 | 210 | -50 | 370 | 450 | 300 | 260 | 250 |
| 与水反应 | ∨ | ∨ | ∨ | ∨ | ||||||
| 与酸反应 | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ||||
| 与氧气反应 | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ||
| 不发生化学反应 | ∨ | ∨ | ||||||||
| 相对于A元素的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
| A | ||||||||||
| I | B | |||||||||
| J | ||||||||||
| H | ||||||||||
17.无色而有刺激性气味的甲酸,是最简单的羧酸液体,熔点8.6℃,沸点100.8℃.化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:HCOOH$\frac{\underline{\;H_{2}SO_{4}\;}}{△}$CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸.
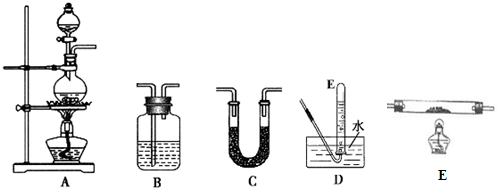
(1)请从上图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置.现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水.将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写).
证明有一氧化碳生成的现象是E中氧化铜粉末变红,E后B装置中澄清石灰水变浑浊.
(2)实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体.查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇.
相关的化学方程式是:2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
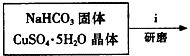
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是研细并混合均匀.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到有黑色固体生成(填写实验现象),说明温度过高.
Ⅱ、甲酸铜的制备:将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的$\frac{1}{3}$时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品.
③制取甲酸铜时需要“趁热过滤”的原因是防止甲酸铜晶体析出.
④用无水乙醇洗涤晶体的目的是减少晶体的损耗以及洗去晶体表面的水和其它杂质.

(1)请从上图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置.现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水.将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写).
| 选用的仪器 | 加入的试剂 |
| A | 甲酸、浓硫酸 |
| D | -- |
(2)实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体.查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇.
相关的化学方程式是:2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:

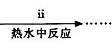
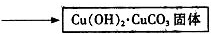
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是研细并混合均匀.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到有黑色固体生成(填写实验现象),说明温度过高.
Ⅱ、甲酸铜的制备:将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的$\frac{1}{3}$时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品.
③制取甲酸铜时需要“趁热过滤”的原因是防止甲酸铜晶体析出.
④用无水乙醇洗涤晶体的目的是减少晶体的损耗以及洗去晶体表面的水和其它杂质.
14.向饱和澄清石灰水中加入生石灰,再恢复到原温度,下列说法正确的是( )
| A. | Ca2+浓度减小 | B. | 溶剂质量减小 | C. | 溶液质量不变 | D. | Ca2+数目增多 |
 .
.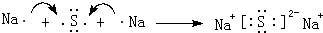 .
.
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.