题目内容
9.NA表示阿伏加德罗常数,下列判断正确的是( )| A. | 在16 g18O2中含有NA个氧原子 | |
| B. | 16 g CH4中含有4NA个C-H键 | |
| C. | 1 mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
分析 A.该氧气的摩尔质量为36g/mol,根据n=$\frac{m}{M}$计算出16g该氧气的物质的量,再计算出含有的氧原子数;
B.甲烷分子中含有4个C-H键,16g甲烷的物质的量为1mol,含有4molC-H键;
C.根据电子守恒计算出生成NO的物质的量及分子数;
D.氧化钠溶于1L水中,所得溶液体积不是1L.
解答 解:A.16g18O2的物质的量为$\frac{16g}{36g/mol}$=$\frac{4}{9}$mol,含有氧原子的物质的量为$\frac{8}{9}$mol,含有$\frac{8}{9}$NA个氧原子,故A错误;
B.16g甲烷的物质的量为:$\frac{16g}{16g/mol}$=1mol,1mol甲烷分子中含有4molC-H键,含有4NA个C-H键,故B正确;
C.1mol铜与足量稀硝酸完全反应失去2mol电子,根据电子守恒可知生成NO的物质的量为:$\frac{2mol}{5-2}$=$\frac{2}{3}$mol,产生了$\frac{2}{3}$NA个NO分子,故C错误;
D.NA个Na+的物质的量为1mol,将该Na2O溶解于1 L水中,所得溶液体积不是1L,则钠离子浓度不是1mol/L,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等之间关系,D为易错点,注意所得溶液体积不是1L.

练习册系列答案
相关题目
19.一定温度下,在带活塞的密闭容器中,反应H2(g)+I2(g)?2HI(g)(正反应为放热反应)达到平衡后,下列说法中不正确的是( )
| A. | 恒压时,通入HI气体,刚开始时正反应速率会减小 | |
| B. | 恒温时,减小容积,平衡不移动,但气体颜色加深 | |
| C. | 恒容时,通入H2,I2的质量分数减小 | |
| D. | 恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小 |
4.下列说法错误的是( )
| A. | 三硝基甲苯的分子式为C7H3N3O6 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 | |
| C. |  在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 | |
| D. | 2,3-二甲基丁烷的核磁共振氢谱中会出现两个峰 |
14.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀; 甲+丙→沉淀; 乙+丙→沉淀; 丙十丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A. | BaCl2 Na2CO3 AgNO3 盐酸 | B. | BaCl2 Na2CO3 盐酸 AgNO3 | ||
| C. | Na2CO3 盐酸 AgNO3 BaCl2 | D. | AgNO3 盐酸 BaCl2 Na2CO3 |
1.在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=“-92.4“kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡向左移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
18.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在下列横线上填写“大于”、“小于”、“等于”.
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为: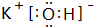 .
.
(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为:
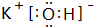 .
.(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
19.下列实验操作正确的是( )
| A. | 过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 | |
| B. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |