题目内容
10.将20gNaOH固体溶于水配成100mL溶液,其密度为1.185g/mL.(1)该溶液中NaOH的物质的量浓度为5mol/L;
(2)该溶液中NaOH的质量分数为16.9%;
(3)从该溶液中取出10ml,其中NaOH的物质的量浓度5mol/L,含NaOH物质的量为0.05mol.
(4)将取出的10mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1mol/L,加水稀释后溶液体积为40mL.
分析 (1)根据n=$\frac{m}{M}$计算出氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出该氢氧化钠溶液的浓度;
(2)根据m=ρV计算出该溶液的质量,再根据ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算出其质量分数;
(3)溶液具有均一性,取出的溶液浓度不变;根据n=cV计算出取出的溶液中含有氢氧化钠的物质的量;
(4)根据稀释过程中溶质的物质的量不变计算出稀释后溶液体积,再根据总体积计算出需要加入水的体积.
解答 解:(1)20g氢氧化钠的物质的量为:$\frac{20g}{40g/mol}$=0.5mol,该溶液中NaOH的物质的量浓度为:$\frac{0.5mol}{0.1L}$=5mol/L,
故答案为:5mol/L;
(2)100mL 1.185g/mL的氢氧化钠溶液的质量为:1.185g/mL×100mL=118.5g,
该溶液中NaOH的质量分数为:$\frac{20g}{118.5g}$×100%=16.9%,
故答案为:16.9%;
(3)从该溶液中取出10mL,所得溶液的浓度不变,则NaOH的物质的量浓度为5mol/L;含NaOH物质的量为:5mol/L×0.01L=0.05mol,
故答案为:5mol/L;0.05mol;
(4)将取出的10mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1mol/L,稀释后溶液体积为:$\frac{0.01L×5mol/L}{1mol/L}$=0.05L=50mL,
需要加入水的体积为:50mL-10mL=40mL,
故答案为:40.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案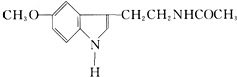
| A. | 它属于芳香族化合物 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13N2H16O2 | D. | 在一定条件下可以发生加成反应 |
| A. | NaOH | B. | H2SO4 | C. | BaCl2 | D. | AgNO3 |
| A. | 加入铝粉能放出H2的溶液中:Na+、Cl-、SO42-、Mg2+ | |
| B. | 0.1mol/L FeCl3溶液中:H+、K+、SCN-、I- | |
| C. | 加酚酞变红的溶液中:Na+、Ba2+、Cl-、Br- | |
| D. | 使紫色石蕊试液变红的溶液中:Ca2+、Na+、HCO3-、Cl- |
 隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以氢氧燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 | |
| C. | 阳极反应CH3CHO-2e-+2H+═CH3COOH+H2O | |
| D. | 电解过程中,由于硫酸钠不参与电极反应,故阳极区始终c(Na+)=2 c(SO42-) |
| A. | 50℃时,纯水中C(H+)>C(OH-) | B. | Kw随温度升高而增大 | ||
| C. | 水的电离过程是放热过程 | D. | 水是强电解质 |