题目内容
实验室制备氯气的反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,有关该反应的说法正确的是( )
| ||
| A、HCl是氧化剂 |
| B、Cl元素被还原 |
| C、MnO2在反应中失去电子 |
| D、生成1 mol Cl2时有2 mol电子转移 |
考点:氧化还原反应
专题:
分析:反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,结合电子转移相等解答.
解答:
解:A.Cl元素化合价升高,被氧化,HCl为还原剂,故A错误;
B.Cl元素化合价升高,被氧化,故B错误;
C.Mn元素化合价降低,被还原,MnO2为氧化剂,反应中得电子,故C错误;
D.Cl元素化合价由-1价升高到0价,则生成1 mol Cl2时有2 mol电子转移,故D正确.
故选D.
B.Cl元素化合价升高,被氧化,故B错误;
C.Mn元素化合价降低,被还原,MnO2为氧化剂,反应中得电子,故C错误;
D.Cl元素化合价由-1价升高到0价,则生成1 mol Cl2时有2 mol电子转移,故D正确.
故选D.
点评:本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考高频考点和常见题型,注意从元素化合价的角度分析,难度不大.

练习册系列答案
相关题目
如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列反应对应的曲线错误的是( )


| A、曲线A是向NaAlO2溶液中滴入盐酸至过量 |
| B、曲线B是向澄清石灰水中通入CO2至过量 |
| C、曲线C是向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D、曲线D是向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
不属于新能源的是( )
| A、风能 | B、潮汐能 |
| C、乙醇汽油 | D、生物质能 |
已知在101kPa、25℃条件下,2mol氢气完全燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
A、H2O(g)=H2 (g)+
| ||
| B、2H2 (g)+O2(g)=2H2O(l)△H=-484 kJ∕mol | ||
C、H2 (g)+
| ||
| D、2H2 (g)+O2(g)=2H2O(g)△H=+484 kJ∕mol |
在NO2与水的反应中( )
| A、NO2既是氧化剂,又是还原剂 |
| B、NO2只是氧化剂 |
| C、NO2只是还原剂 |
| D、氮元素的化合价不发生变化 |
100mL0.3mol?L-1Na2SO4溶液和50mL0.2mol?L-1Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为( )
| A、0.2mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.5 mol?L-1 |
NA为阿伏加德罗常数,下列物质所含分子数最少的是( )
| A、含NA个分子的二氧化硫 |
| B、0.5 mol氧气 |
| C、标准状况下5.6 L氢气 |
| D、9 g水 |
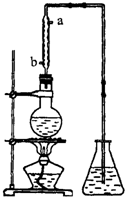 久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:
久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应: