题目内容
【题目】用粗制ZnO粉末(含杂质Fe、Ni等)制备高纯ZnO的流程如下:
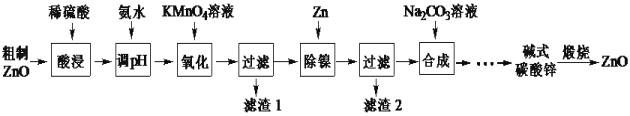
已知:本实验条件下,Ni2+不能被氧化,高锰酸钾还原产物为MnO2;过滤出滤渣1达到除铁目的。
(1)加快酸浸速率可采取的措施_____________________________。(任写一条)
(2)写出“除镍”步骤发生的主要反应离子方程式____________________________。
(3)“滤渣2”的成分是______。
(4)流程中“![]() ”涉及的操作有______、洗涤、______。
”涉及的操作有______、洗涤、______。
(5)获得的碱式碳酸锌需要用水洗涤,检验沉淀是否洗涤干净的方法是_____。
(6)若碱式碳酸锌的成分是ZnCO3· xZn(OH)2。取干燥后的碱式碳酸锌11.2g,煅烧后可得到产品8.1g,则x等于______。
【答案】适当升高温度或适当增大硫酸浓度 Zn+ Ni2+= Zn2++ Ni Ni、Zn 过滤 干燥 取少量最后一次洗涤液,加入盐酸酸化的BaCl2溶液,无白色沉淀产生,则洗涤干净 1
【解析】
(1)加快酸浸速率可采取的措施有:增大温度,增大反应的接触面积,提高酸的浓度等;
(2)根据此题需要制备的是氧化锌得出,除镍加入金属锌,发生置换反应;
(3)除镍后,得到镍以及过量的锌单质;
(4)省略的操作主要是过滤洗涤干燥冷却结晶;
(5)杂质主要有碳酸钠溶液,目的是检验碳酸根;
(6)根据煅烧后得到的产物是氧化锌来进行计算;
(1)加快酸浸速率可采取的措施有:增大温度,增大反应的接触面积,提高酸的浓度等,所以任写一条即可;
(2)根据此题需要制备的是氧化锌得出,除镍加入金属锌,不引入新的杂质,发生置换反应,方程式为Zn+ Ni2+= Zn2++ Ni;
(3)除镍时,为保证镍元素完全除去,需要加入过量的锌单质,所以得到的滤渣2有镍以及过量的锌单质;
(4)省略的操作主要是过滤洗涤干燥冷却结晶;
(5)杂质主要有碳酸钠溶液,目的是检验碳酸根,所以取少量最后一次洗涤液,加入盐酸酸化的BaCl2溶液,无白色沉淀产生,则洗涤干净;
(6)根据煅烧后得到的产物是氧化锌来进行计算,8.1g是氧化锌的质量,根据氧化锌的摩尔质量为81g/mol,推断出氧化锌有0.1mol,根据ZnCO3· xZn(OH)2分解可知消耗的质量主要是二氧化碳和水的质量,设二氧化碳有xmol,水有ymol,所以x+y=1mol,44x+18y=3.1g,解得x=0.05,y=0.05,所以根据比例,x=1;

【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100ml同物质的量浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定):
① | ② | ③ | ④ | |
铝热剂质量/g | 5g | 10g | 15g | 20g |
气体体积/L | 2.24L | 4.48L | 6.72L | 6.72L |
试完成下列计算:
(1)NaOH溶液的物质的量浓度_______________。
(2)该铝热剂中铝的质量分数_____________
(3)20g该铝热剂发生铝热反应理论上产生铁的质量是多少?________(写出步骤)