题目内容
【题目】下列反应能用离子方程式2H+ + CO32-=CO2↑ + H2O表示的是
A.HCl溶液与MgCO3反应
B.CH3COOH与K2CO3溶液反应
C.HNO3溶液与NaHCO3溶液反应
D.H2SO4溶液与(NH4)2CO3溶液反应
【答案】D
【解析】
A. MgCO3微溶偏不溶于水,通常不以离子态参加反应,故不拆;盐酸是强酸,二者之间发生反应的实质是:MgCO3+2H+=CO2↑+H2O+Mg2+,故A错误;
B. CH3COOH是弱酸,在离子方程式中不能拆,CH3COOH与K2CO3溶液反应的离子方程式为:CO32- + 2CH3COOH = 2CH3COO- + CO2![]() + H2O,故B错误;
+ H2O,故B错误;
C. NaHCO3溶液中HCO3-不能拆成H+和CO32-,离子方程式为:HCO3-+H+=H2O+CO2↑,故C错误;
D. H2SO4是强酸,(NH4)2CO3是可溶性盐,反应的离子方程式为:2H+ + CO32-=CO2↑ + H2O,故D正确;
正确答案是D。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
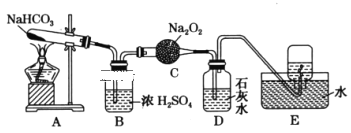
初中学业考试导与练系列答案【题目】Na2S2O3可用于照相业作定影剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制备,装置如图。

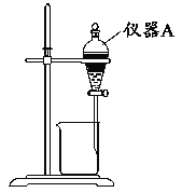
(1)仪器a的名称为____。
(2)A装置中,NaOH溶液的作用是___。
(3)D中生成Na2S2O3的化学方程式为___。
(4)装置C的作用有___、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是___。
(5)本实验所需的Na2S可由硫化钠碱坯(主要含Na2S,还含少量Na2SO4、炭粉等杂质)制备。
已知Na2S的溶解度、固相成分与温度的关系如表:
温度/℃ | 溶解度/g | 固相 |
-10 | 10.3 | Na2S·9H2O+冰 |
10 | 13.6 | Na2S·9H2O |
20 | 18.7 | Na2S·9H2O |
40 | 28.5 | Na2S·9H2O |
48 | 35.7 | Na2S·9H2O+Na2S·6H2O |
60 | 39.1 | Na2S·6H2O |
80 | 49.1 | Na2S·6H2O |
91.5 | 61.3 | Na2S·6H2O+Na2S·5.5H2O |
请补充完整由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,__,得到Na2S·9H2O晶体(须用的试剂:BaS、无水乙醇)。
【题目】碲(Te)元素是当今新材料的主要成分之一。工业上从电解法精炼铜的阳极泥中提取纯度较高的碲,经预处理后的阳极泥中含TeO2及铁、铅、铜的化合物等,通过以下流程得到:

已知:①TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
②部分难溶物的Ksp如表:
化合物 | Fe(OH)2 | Pb(OH)2 | Cu(OH)2 | FeS | PbS | CuS |
Ksp | 8×10-16 | 1.2×10-15 | 1.3×10-20 | 4×10-19 | 1×10-28 | 6×10-36 |
回答下列问题:
(1)“碱浸”时TeO2发生反应的化学方程式为___________。
(2)加入Na2S溶液的主要目的是___________。
(3)“沉碲”发生反应的化学方程式为_______。
(4)“酸溶”后,将SO2通入溶液中进行“还原”得到粗碲,该反应的化学方程式是___________。
(5)电解法提纯粗碲时,以Na2TeO3溶液为电解质溶液,阳极材料为___________。电解过程中阴极的电极反应式为___________。
(6)常温下,向0.lmol/LNa2TeO3溶液中滴加盐酸,当溶液pH=5时,溶液中c(TeO32-):c(H2TeO3)=___________。(已知:H2TeO3的Ka1=1.0×10-3Ka2=2.0×10-8)