题目内容
【题目】实验室需要0.5 mol/L H2SO4溶液500 mL。根据溶液的配制情况回答下列问题:
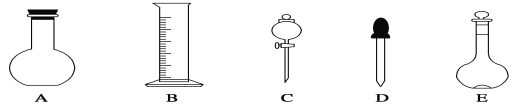
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号)。
(2)下列操作中,500ml容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取220 mL溶液
(3)实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液的浓度将____ 0.5mol/L(填“大于”“等于”或“小于”,下同)。若溶液未冷却即转移至容量瓶定容,则所配制溶液浓度将________0.5 mol/L。
(4)根据计算得知:所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。
【答案】A C BCD 小于 大于 13.6
【解析】
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质;
(3)根据m=nM=cVM计算氢氧化钠的质量;根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)浓硫酸的物质的量浓度c= ![]() ,再根据稀释公式可以求得需要浓硫酸的体积。
,再根据稀释公式可以求得需要浓硫酸的体积。
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,所以不需要的仪器是AC,故答案为:A C;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质;故选BCD;
(3)若定容时仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低,故所得溶液浓度 小于0.5mol/L;溶液有热胀冷缩的性质,若NaOH在溶解后未冷却到室温便注入容量瓶内,导致溶液的体积偏小,所以配制溶液的浓度偏高,即故所得溶液浓度大于0.5mol/L,故答案为:小于;大于;
(4)质量分数为98%,密度为1.84g/cm3的浓硫酸的物质的量浓度c= ![]() =
= ![]() =18.4mol/L,需要浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:0.5L×0.5mol/L=V×18.4mol/L解得V=0.0136L=13.6mL,正确答案是13.6mL。
=18.4mol/L,需要浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:0.5L×0.5mol/L=V×18.4mol/L解得V=0.0136L=13.6mL,正确答案是13.6mL。

【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2