题目内容
1.在一定温度、压强和催化剂条件下,把N2和H2按1:3(体积比)混合,当反应达到平衡时,混合气体中NH3占25%(体积比),求:(1)N2的转化率40%;
(2)反应前后体积之比5:4;
(3)平衡混合气的平均相对分子质量10.6.
分析 在一定温度、压强和催化剂条件下,把N2和H2按1:3(体积比)混合,体积比等于物质的量比,设物质的量分别为n mol、3n mol,转化的氮气为xmol,则
N2(g)+3H2(g)?2NH3(g)
开始 n 3n 0
转化 x 3x 2x
平衡 n-x 3n-3x 2x
当反应达到平衡时,混合气体中NH3占25%(体积比),
可知$\frac{2x}{n-x+3n-3x+2x}$×100%=25%,
解得x=0.4n mol,
(1)转化率=$\frac{转化量}{开始量}$×100%;
(2)反应前后的体积比等于物质的量之比;
(3)平均相对分子质量=$\frac{总质量}{平衡时总物质的量}$.
解答 解:在一定温度、压强和催化剂条件下,把N2和H2按1:3(体积比)混合,体积比等于物质的量比,设物质的量分别为n mol、3n mol,转化的氮气为xmol,则
N2(g)+3H2(g)?2NH3(g)
开始 n 3n 0
转化 x 3x 2x
平衡 n-x 3n-3x 2x
当反应达到平衡时,混合气体中NH3占25%(体积比),
可知$\frac{2x}{n-x+3n-3x+2x}$×100%=25%,
解得x=0.4n mol,
(1)N2的转化率为$\frac{0.4n}{n}$×100%=40%,故答案为:40%;
(2)反应前后体积之比为(n+3n):(4n-2×0.4n)=5:4,故答案为:5:4;
(3)平衡混合气的平均相对分子质量为$\frac{28n+6n}{3.2n}$=10.6,故答案为:10.6.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法计算格式、体积与物质的量关系等为解答的关键,侧重分析与计算能力的考查,注意平均相对分子质量的计算方法,题目难度不大.

| A. | 棉花 | B. | 光导纤维 | C. | 人造棉 | D. | 蚕丝 |
| A. | Si | B. | Ge | C. | Sn | D. | Pb |
| A. | 静电除尘器除去空气或工厂废气中的飘尘是利用胶体粒子的带电性而加以除去 | |
| B. | 医学上的血液透析原理与胶体的渗析类似,透析膜与半透膜类似 | |
| C. | 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 由于胶休粒子之间的排斥作用,胶体粒子不易聚集成大的颗粒,所以胶体的性质相对比较稳定 |
| A. | 蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 鸡蛋白溶液中加CuSO4溶液析出沉淀,该过程属于化学变化 | |
| C. | 乙烯和氯乙烯都属于不饱和烃,可发生加聚反应 | |
| D. | 油脂在酸的作用下可发生水解,工业上利用该反应生产肥皂 |
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 增加炼铁高炉的高度可以降低尾气中CO的含量 | |
| C. | 吸热反应的发生都需要加热,吸热反应都没有利用价值 | |
| D. | 粉状的煤比块状的煤燃烧效率高 |
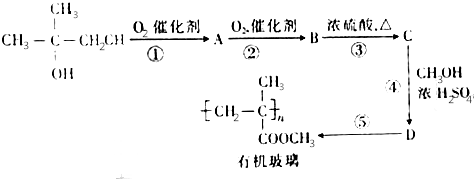
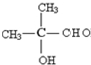 、C
、C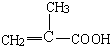
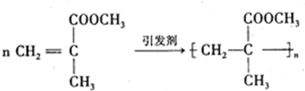 .
.