题目内容
 某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A、Al(OH)3的电离方程式为:Al(OH)3═Al3++3OH- |
| B、a点溶液中有:c(H+)+c(Al3+)═c(OH-)+3c(Cl-) |
| C、曲线X表示盐酸稀释过程的PH变化 |
| D、b、c两溶液c(OH-)及c(Cl-)均相等 |
考点:盐类水解的应用,pH的简单计算
专题:盐类的水解专题
分析:根据盐酸是强酸,完全电离,氯化铵是能水解的盐,水解显示酸性,加水稀释促进水解的进行,
A、氢氧化铝的电离方程式为:AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,溶液的导电能力和溶液中自由移动离子的多少有关;
B、根据电荷守恒分析;
C、加水稀释的过程中,盐酸不能继续电离,氯化铵溶液中铵离子可继续水解;
D、b、c两溶液PH相同,则c(H+)、c(OH-)相等,根据电荷守恒进行比较可知c(Cl-)不相等.
A、氢氧化铝的电离方程式为:AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,溶液的导电能力和溶液中自由移动离子的多少有关;
B、根据电荷守恒分析;
C、加水稀释的过程中,盐酸不能继续电离,氯化铵溶液中铵离子可继续水解;
D、b、c两溶液PH相同,则c(H+)、c(OH-)相等,根据电荷守恒进行比较可知c(Cl-)不相等.
解答:
解:盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线x是盐酸溶液的,含a、b点的曲线y是氯化铵溶液的.
A、氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,故A错误;
B、根据电荷守恒,a点溶液中有:c(H+)+3c(Al3+)═c(OH-)+c(Cl-),故B错误;
C、加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线x是盐酸溶液的,含a、b点的曲线y是氯化铵溶液的,故C正确;
D、b、c两溶液PH相同,则c(H+)、c(OH-)相等,根据电荷守恒进行比较可知c(Cl-)不相等,故D错误;
故选C.
A、氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,故A错误;
B、根据电荷守恒,a点溶液中有:c(H+)+3c(Al3+)═c(OH-)+c(Cl-),故B错误;
C、加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线x是盐酸溶液的,含a、b点的曲线y是氯化铵溶液的,故C正确;
D、b、c两溶液PH相同,则c(H+)、c(OH-)相等,根据电荷守恒进行比较可知c(Cl-)不相等,故D错误;
故选C.
点评:本题考查酸、盐溶液的稀释,注意弱电解质溶液稀释时的浓度变化及加水促进弱电解质电离的特点即可解答,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
容积不变的密闭容器中可逆反应H2(g)+I2(g)?2HI(g)达平衡时的标志是( )
| A、混合气体密度恒定不变 |
| B、混合气体压强不再改变 |
| C、H2、I2、HI的浓度相等 |
| D、HI在混合气体中的体积分数不变 |
在容积一定的密闭容器中,反应A(g)+2B(g)?2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则
应满足的是( )
| X |
| Y |
A、1<
| ||
B、3<
| ||
C、0.25<
| ||
D、0.25<
|
同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是① ②
② ③
③ ④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
 ②
② ③
③ ④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )| A、①和② | B、①和③ |
| C、①和④ | D、③和⑥ |
有关如图装置的说法中正确的是( )


| A、氧化剂与还原剂必须直接接触,才能发生反应 |
| B、乙池中电极反应式为NO3-+4H++e-═NO2↑+2H2O |
| C、当铜棒质量减少6.4g时,甲池溶液质量增加6.4g |
| D、当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12L O2,将使气体全部溶于水 |





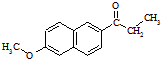 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式: 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).