题目内容
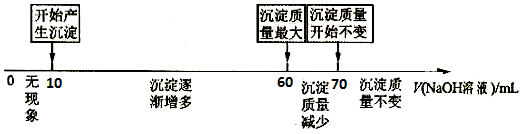
10.有关对食盐叙述错误的是( )| A. | 可作食品调味剂 | B. | 可作食品防腐剂 | ||
| C. | 可作配制0.9%生理盐水的原料 | D. | 电解饱和食盐水可得到金属钠 |
分析 食盐常用于调味品,可使细胞脱水而起到防腐剂的作用,医疗上可作配制0.9%生理盐水的原料,工业常用于氯碱工业制备氯气、氢气和氢氧化钠,也常用于纯碱工业,电解熔融的食盐可得到金属钠,以此解答.
解答 解:A.钠元素为人体不可缺少的元素,食盐可用于食品调味剂,具有咸味,故A正确;
B.食盐可使细胞脱水而起到防腐剂的作用,故B正确;
C.人的上皮细胞生活的环境是0.9%的生理盐水,如果盐水的浓度过高或过低,都可能使细胞发生变形,滴加0.9%的生理盐水,以保持细胞的正常形态,故C正确;
D.钠性质活泼,与水剧烈反应,工业电解饱和食盐水2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,制备氯气、氢气和氢氧化钠,用食盐、氨气、二氧化碳制备纯碱,所以电解食盐水不能制得钠,应电解熔融氯化钠,2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,得到金属钠,故D错误.
故选D.
点评 本题考查氯化钠的性质与用途,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学元素,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
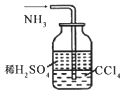
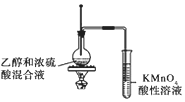
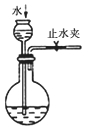
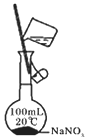
6.用下列实验装置进行相应实验,能达到实验目的是( )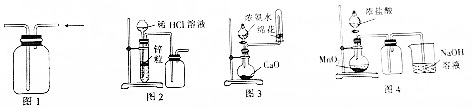

| A. | 用图1所示装置收集CO和NO | B. | 用图2所示装置制取少量氢气 | ||
| C. | 用图3所示装置制取少量氨气 | D. | 用图4所示装置制取少量氯气 |
18.某微粒的核外L层电子的数目为8个,M层8个,该微粒一定是( )
| A. | 原子 | B. | 阴离子 | C. | 阳离子 | D. | 无法确定 |
5.国际相对原子质量表上查得的氢(H)是1.008,这是指( )
| A. | 同位素1H的相对原子质量 | |
| B. | 氢元素的平均相对原子质量 | |
| C. | 氢元素各同位素质量数与百分含量算出的平均值 | |
| D. | 同位素2H的相对原子质量 |
15.图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中维生素C表现出
还原性(填“氧化性”或“还原性”).
(4)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如图:
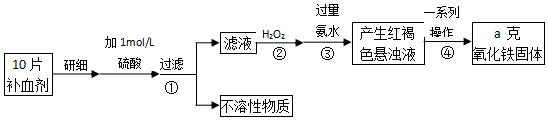
请回答下列问题:
a.②中H2O2的作用是将Fe2+全部氧化为Fe3+.
b.④中一系列处理的操作步骤为 过滤、洗涤、灼烧、冷却、称量.
c.若实验无损耗,则每片补血剂含铁元素的质量分数为$\frac{7a}{b}%$.
d.下列操作会导致所测定的铁元素含量偏高的是BC
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分.
| 怀化市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中维生素C表现出
还原性(填“氧化性”或“还原性”).
(4)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如图:

请回答下列问题:
a.②中H2O2的作用是将Fe2+全部氧化为Fe3+.
b.④中一系列处理的操作步骤为 过滤、洗涤、灼烧、冷却、称量.
c.若实验无损耗,则每片补血剂含铁元素的质量分数为$\frac{7a}{b}%$.
d.下列操作会导致所测定的铁元素含量偏高的是BC
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分.
2.下列叙述不正确的是( )
| A. | 用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 | |
| B. | 用反应热数据的大小判断不同反应反应速率的快慢 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 用平衡常数的大小判断化学反应可能进行的程度 |
20.NA为阿伏加德罗常数,下列关于0.2mol/L K2SO4溶液的正确说法是( )
| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+离子 | |
| C. | 1L溶液中K+离子浓度是0.2mol/L | |
| D. | 2L溶液中SO42-离子浓度是0.4mol/L |