题目内容
20.某化学小组为测定碘盐中KIO3的质量分数并制备少量KIO3,进行了如下实验.I.测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O; I2+2Na2S2O3=2Na I+Na 2S4O6
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol•L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据;重复滴定2次,平均消耗Na2S2O3溶液12.00mL.
(1)步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有250mL容量瓶.
(2)步骤三中到达滴定终点时的现象为溶液蓝色褪色.
(3)实验测得此加碘盐中KIO3的质量分数$\frac{428c}{a}$%.
Ⅱ.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到.该化学小组通过以下装置制备KIO3.
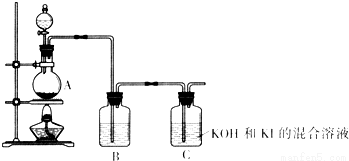
(4)装置A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(5)装置B中的试剂为饱和食盐水.
(6)写出装置C中生成KIO3的离子方程式3Cl2+I-+6OH-=6Cl-+IO3-+3H2O.
(7)上述实验装置存在一处明显缺陷,请指出缺少吸收氯气的尾气吸收装置.
分析 Ⅰ、(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),据此判断;
(2)步骤二中生成I2,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色;
(3)根据关系式KIO3~3I2~6Na2S2O3计算;
Ⅱ、(4)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,由装置图可知,装置A为制备氯气,加热制备氯气,实验室通常用二氧化锰与浓盐酸加热反应生成氯化锰、氯气与水制备;
(5)浓盐酸具有挥发性,制备的氯气中含有HCl,影响C装置中的反应,装置B吸收HCl将其除去,通常用饱和食盐水吸收HCl,降低氯气的溶解;
(6)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,故装置C中发生反应为氯气在碱性条件下氧化I-,生成氯离子、碘酸根与水;
(7)由于氯气有毒,直接排放到大气中,会污染大气,应在C之后添加尾气吸收装置,吸收氯气,防止污染大气.
解答 解:Ⅰ、(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,
故答案为:250mL容量瓶;
(2)步骤二中生成I2,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色,
故答案为:溶液蓝色褪色;
(3)25mL溶液消耗Na2S2O3的物质的量为c mol•L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012cmol×10=0.12cmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1 6
xmol 0.12cmol
所以x=0.02c
故加碘盐中KIO3的质量分数$\frac{0.02cmol×214g/mol}{ag}$×100%=$\frac{428c}{a}$%,
故答案为:$\frac{428c}{a}$%;
Ⅱ、(4)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,由装置图可知,装置A为制备氯气,加热制备氯气,实验室通常用二氧化锰与浓盐酸加热反应生成氯化锰、氯气与水制备,装置A的反应离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(5)浓盐酸具有挥发性,制备的氯气中含有HCl,影响C装置中的反应,装置B吸收HCl将其除去,通常用饱和食盐水吸收HCl,降低氯气的溶解,
故答案为:饱和食盐水;
(6)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,故装置C中发生反应为氯气在碱性条件下氧化I-,生成氯离子、碘酸根与水,反应离子方程式为3Cl2+I-+6OH-=6Cl-+IO3-+3H2O,
故答案为:3Cl2+I-+6OH-=6Cl-+IO3-+3H2O;
(7)由于氯气有毒,直接排放到大气中,会污染大气,应在C之后添加尾气吸收装置,吸收氯气,防止污染大气,
故答案为:缺少吸收氯气的尾气吸收装置.
点评 本题考查了氧化还原滴定的应用、对实验原理理解与实验装置的评价、阅读获取信息的能力,题目难度中等,是对知识的综合运用与分析解决问题能力的考查,注意基础知识的掌握.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案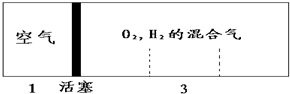 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | 2:7 | B. | 4:5 | C. | 5:4 | D. | 7:6 |
| A. | 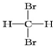 和 和 互为同分异构体 互为同分异构体 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,能说明侧链对苯环性质有影响 | |
| C. | 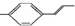 分子中所有碳原子可能都共面 分子中所有碳原子可能都共面 | |
| D. | 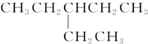 的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 |
| A. | 肥皂水遇Ca2+、Mg2+ 含量较高的水有白色沉淀生成 | |
| B. | 水稻田使用NH4NO3的肥效较差 | |
| C. | 肾功能衰竭等疾病引起的血液中毒,要利用血液渗析进行治疗,渗析原理与胶体的渗析类似 | |
| D. | 在冶金厂和水泥厂常用高压电对气溶胶作用以除去大量烟尘,减小对空气的污染 |
| A. | C4H10 | B. | C4H4Cl2 | C. | CH2Cl2 | D. | C5H12 |
| A. | 金属与盐溶液的反应都是置换反应 | |
| B. | 阴离子都只有还原性 | |
| C. | 离子化合物中肯定存在离子键,可能不存在共价键 | |
| D. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
| A. | Na2O2与SO2反应生成Na2SO3和O2 | |
| B. | Na2O2投入到酚酞溶液中,溶液变红 | |
| C. | Na2O2与水反应,Na2O2既是氧化剂,又是还原剂 | |
| D. | Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物 |
已知:Zn2++2OH-═Zn(OH)2↓ Zn(OH)2+2OH-═ZnO${\;}_{2}^{2-}$+2H2O↓
甲:[污水]$→_{①}^{+过量NaOH溶液,过滤}$[沉淀]$→_{②}^{△}$[CuO]$→_{③}^{+H_{2},△}$[Cu]
乙:[污水]$→_{①}^{+过量铁粉,过滤}$[滤渣]$→_{②}^{△}$[CuO]$\stackrel{+H_{2},△}{→}$[Cu]
丙:[污水]$→_{①}^{+过量铁粉,过滤}$[滤渣]$→_{②}^{+稀盐酸,过滤}$[滤渣]$→_{③}^{△}$[CuO]$→_{④}^{+H_{2},△}$[Cu]
下列判断正确的是( )
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |