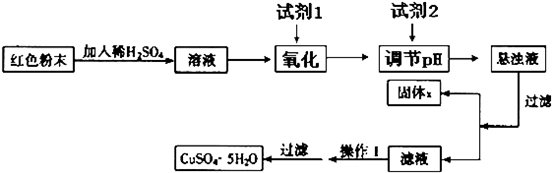
题目内容
工业利用冶铜炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制Fe2O3的生产流程示意图:炉渣
滤液
沉淀
氧化铁,经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
| 盐酸浸泡 |
| 过滤 |
| 氧化处理 |
| 足量的 |
| NaOH溶液 |
| 过滤 |
| 洗涤 |
| 煅烧 |
| A、Al |
| B、Al(OH)3 |
| C、Al3+ |
| D、[Al(OH)4]- |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:炉渣被盐酸浸泡处理后,滤液中的铝元素以Al3+形式存在,向滤液中加入足量的氢氧化钠,反应生成[Al(OH)4]-.
解答:
解:炉渣被盐酸处理后,滤液中Al以Al3+形式存在,向滤液中加入足量的氢氧化钠,反应生成[Al(OH)4]-
故选:D.
故选:D.
点评:本题主要考查的是铝及其化合物的性质、化学工艺流程,难度不大,掌握氢氧化铝的两性是解决本题的关键,需要学生具备扎实的基础.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气(氦气是单原子分子)在标准状况下的体积约为11.2L |
| B、在标准状况下,11.2L H2O含有的分子数为0.5NA |
| C、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D、.25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
能在水溶液中大量共存的一组离子是( )
| A、NH4+、Ag+、NO3-、I- |
| B、Na+、K+、AlO2-、OH- |
| C、Ca2+、Fe2+、ClO-、Cl- |
| D、Mg2+、Al3+、CO32-、SO42- |
从海水中提取镁的工业流程如图所示,下列说法正确的是( )

| A、在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯 |
| B、步骤⑥电解MgCl2时,阴极产生H2 |
| C、步骤⑤应将晶体置于HCl气体氛围中脱水 |
| D、上述工艺流程中的反应未涉及氧化还原反应 |
 N2O5是一种新型绿色硝化剂,一种制备方法是用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:(隔膜不允许水分子通过,H+可以通过)下列说法正确的是( )
N2O5是一种新型绿色硝化剂,一种制备方法是用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:(隔膜不允许水分子通过,H+可以通过)下列说法正确的是( )| A、Y是负极,电极反应式:H2O2+2e-=2OH- |
| B、Z是阳极,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+ |
| C、电流从X流出经导线流入W极 |
| D、制备10.8gN2O5至少需要消耗硼氢化钠0.87g |