题目内容
表面被氧化的铝片溶于过量稀盐酸:
化学方程式:① ;② ;
离子方程式:① ;② .
化学方程式:①
离子方程式:①
考点:镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:铝为活泼金属,表面被氧化的铝片含有氧化铝,氧化铝和盐酸反应生成氯化铝和水,铝和盐酸生成氯化铝和氢气,据此分析结合方程式书写方法解答.
解答:
解:铝为活泼金属,表面被氧化的铝片含有氧化铝,表面被氧化的铝片溶于过量稀盐酸,先是氧化铝和盐酸反应,氧化铝与盐酸反应生成氯化铝和水,化学方程式为:Al2O3+6HCl=2AlCl3+3H2O,氧化铝、水写化学式,离子方程方程式为:Al2O3+6H+=2Al3++3H2O;
后是铝和盐酸反应,铝与稀盐酸反应生成氯化铝与氢气,化学方程式为:2Al+6HCl═2AlCl3+3H2↑;氯化铝是强电解质易溶于水,写成离子形式,氢气是为单质写成化学式,离子方程式为:2Al+6H+═2Al3++3H2↑,
故答案为:Al2O3+6HCl=2AlCl3+3H2O;2Al+6HCl═2AlCl3+3H2↑;Al2O3+6H+=2Al3++3H2O;2Al+6H+═2Al3++3H2↑;
后是铝和盐酸反应,铝与稀盐酸反应生成氯化铝与氢气,化学方程式为:2Al+6HCl═2AlCl3+3H2↑;氯化铝是强电解质易溶于水,写成离子形式,氢气是为单质写成化学式,离子方程式为:2Al+6H+═2Al3++3H2↑,
故答案为:Al2O3+6HCl=2AlCl3+3H2O;2Al+6HCl═2AlCl3+3H2↑;Al2O3+6H+=2Al3++3H2O;2Al+6H+═2Al3++3H2↑;
点评:本题考查离子反应方程式及化学反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,注意反应物与生成物的分析,题目难度不大.

练习册系列答案
相关题目
下列化学实验事实及其解释都正确的是( )
| A、氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 |
| B、SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| C、用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) |
| D、某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO42- |
工业利用冶铜炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制Fe2O3的生产流程示意图:炉渣
滤液
沉淀
氧化铁,经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
| 盐酸浸泡 |
| 过滤 |
| 氧化处理 |
| 足量的 |
| NaOH溶液 |
| 过滤 |
| 洗涤 |
| 煅烧 |
| A、Al |
| B、Al(OH)3 |
| C、Al3+ |
| D、[Al(OH)4]- |
地壳中含量最多的金属元素和含量最多的非金属元素形成的化合物,其式量为( )
| A、40 | B、56 |
| C、102 | D、160 |
下列离子方程式书写正确的是( )
| A、将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO |
| B、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++OH-+H++SO42-=BaSO4↓+2H2O |
| C、向Ca(H2PO4)2溶液中滴入过量的NaOH溶液 3Ca2++6H2PO4-+12OH-=Ca3(PO4)2↓+4PO43-+12H2O |
| D、112mL(标况)Cl2通入10mL1mol/L的FeBr2溶液中 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
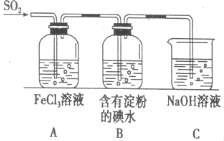 SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: