题目内容
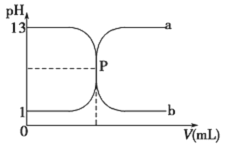
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
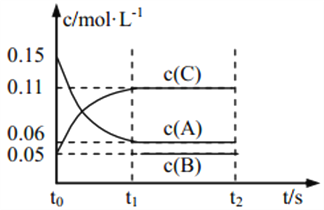
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
【答案】B
【解析】t0~t1阶段,A 的浓度变化为0.15-0.06=0.09 mol·L-1,t0~t1阶段的平均反应速率为0.09/15=0.006 mol·L-1·s-1, A错误;t1时该反应达到平衡, A 的转化率为=0.09/0.15×100=60%, B正确;根据反应3A(g) ![]() B(g)+2C(g)可知,反应达平衡后,c(A)=0.09 mol·L-1, c(B)=O.03 mol·L-1,由图像可知反应达平衡后,c(B)=0.05 mol·L-1,所以B的起始的浓度为0.02 mol·L-1,B的起始的物质的量为0.02×2=0.04 mol,C错误;t0~t1 阶段,c(A)=0.09 mol·L-1,n(A)=0.09×2=0.18 mol,此时放热a kJ,如果有3 mol A完全反应,放热为50 a /3 kJ,即3A(g)
B(g)+2C(g)可知,反应达平衡后,c(A)=0.09 mol·L-1, c(B)=O.03 mol·L-1,由图像可知反应达平衡后,c(B)=0.05 mol·L-1,所以B的起始的浓度为0.02 mol·L-1,B的起始的物质的量为0.02×2=0.04 mol,C错误;t0~t1 阶段,c(A)=0.09 mol·L-1,n(A)=0.09×2=0.18 mol,此时放热a kJ,如果有3 mol A完全反应,放热为50 a /3 kJ,即3A(g)![]() B(g)+2C(g) ΔH=-50a/3 kJ·mol-1, D错误;正确选项B。
B(g)+2C(g) ΔH=-50a/3 kJ·mol-1, D错误;正确选项B。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】下表是氧化镁和氯化镁的熔、沸点数据:请参考以上数据分析,从海水中提取镁,正确的方法是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2852 | 714 |
沸点/℃ | 3600 | 1410 |
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2晶体
MgCl2晶体![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融) ![]() Mg
Mg
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |