题目内容
15.判断下列离子方程式,正确的是( )| A. | 向100mL 0.1mol•L-1 FeBr2溶液中通入0.012mol Cl2:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl- | |
| B. | 少量的铁与稀硝酸反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O | |
| C. | 铜与氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 过量二氧化碳通入澄清石灰水:Ca2++2OH-+CO2═CaCO3↓+H2O |
分析 A.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子然后氧化溴离子;
B.铁少量反应生成三价铁离子;
C.电荷不守恒;
D.过量二氧化碳通入澄清石灰水反应生成碳酸氢钙.
解答 解:A.向100mL 0.1mol•L-1 FeBr2溶液中通入0.012mol Cl2,离子方程式:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl-,故A正确;
B.少量的铁与稀硝酸反应,离子方程式:Fe+NO3-+4H+═Fe3++NO↑+2H20,故B错误;
C.铜与氯化铁溶液反应,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.过量二氧化碳通入澄清石灰水:CO2+OH-=HCO3-,故D错误;
故选:A.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法即可解答,题目难度不大.

练习册系列答案
相关题目
5.在研究物质变化时,不但要着眼于物质种类的变化,也要关注物质状态的变化.
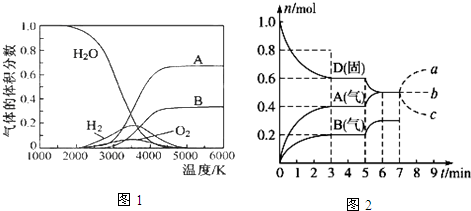
(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
①比较大小:a= b+c(填“>”、“<”或“=”)
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.

(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
| 压强(KPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.
6.下列离子方程式书写正确的是( )
| A. | 铁和盐酸:Fe+2H+═Fe3++H2↑ | |
| B. | 石灰石和硝酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜和硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 氢氧化钡溶液和硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
3.能正确表示下列反应的离子方程式为( )
| A. | 用铜电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| B. | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
20. 将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是
将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是
( )
 将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是
将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )
| A. | 当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7 | |
| B. | 当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝 | |
| C. | NaOH溶液的物质的量浓度为5 mol•L-1 | |
| D. | 生成气体的体积为10.08L |
7.下列离子方程式表达正确的是( )
| A. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
4.今年世界环境日中国主题为“践行绿色生活”,该主题旨在增强全民环境意识、节约意识、生态意识,选择低碳、节俭的绿色生活方式和消费模式,形成人人、事事、时时崇尚生态文明的社会新风尚,为生态文明建设奠定坚实的社会和群众基础.下列不符合这一主题的是( )
| A. | 建立合法、公开的地沟油回收生产制度,将生产的地沟油用作工业用油 | |
| B. | 将生活垃圾分类回收、加工、使之再生、再利用 | |
| C. | 生活污水、工业废水不要乱排放,通过打深井,将之排到地层深处 | |
| D. | 不用一次性筷子、不浪费纸张、不浪费粮食、做“光盘”一族 |
5.下列排列顺序不正确的是( )
| A. | 热稳定性:HF>HCl>HBr | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 原子半径:Na>S>O | D. | 元素金属性:Na>Mg>Al |
 一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.