题目内容
20. 将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是
将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )
| A. | 当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7 | |
| B. | 当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝 | |
| C. | NaOH溶液的物质的量浓度为5 mol•L-1 | |
| D. | 生成气体的体积为10.08L |
分析 根据图象知,加入20mL氢氧化钠溶液时开始生成沉淀,说明金属与硫酸反应后的溶液中含有过量的氢离子,当加入20ml氢氧化钠溶液时,此时溶质为硫酸钠、硫酸铝和硫酸镁,由于铝离子部分水解,溶液为酸性;当加入200mL氢氧化钠溶液时,此时溶质为硫酸钠,根据钠离子守恒及硫酸的物质的量可计算出氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出该氢氧化钠溶液的物质的量浓度;
溶解的沉淀的物质的量就是n(Al(OH)3)=0.35mol-0.15mol=0.2mol,
根据铝原子守恒知n(Al(OH)3)=n(Al)=0.2mol;未溶解的沉淀的物质的量是n(Mg(OH)2)=0.15mol,然后根据电子守恒可计算出生成气体的物质的量,由于没有告诉在标况下,无法计算生成氢气的体积.
解答 解:A.加入20mL氢氧化钠溶液时开始生成沉淀,说明金属与硫酸反应后的溶液中含有过量的氢离子,当加入20ml氢氧化钠溶液时,此时溶质为硫酸钠、硫酸铝和硫酸镁,由于铝离子部分水解,溶液为酸性,故A错误;
B.当加入20ml氢氧化钠溶液时,此时溶质为硫酸钠、硫酸铝和硫酸镁,故B错误;
C.当加入200mL氢氧化钠溶液时,此时溶质为硫酸钠,根据钠离子守恒及硫酸的物质的量可知氢氧化钠的物质的量为:n(NaOH)=2n(Na2SO4)=2n(H2SO4)=2×2mol/L×0.25L=1mol,该氢氧化钠溶液的浓度为:$\frac{1mol}{0.2L}$=5mol/L,故C正确;
D.根据图象知,溶解的沉淀的物质的量为氢氧化铝:n[Al(OH)3]=0.35mol-0.15mol=0.2mol,
根据铝原子守恒知n[Al(OH)3]=n(Al)=0.2mol;未溶解的沉淀的物质的量是n[Mg(OH)2]=0.15mol,根据镁原子守恒知n[Mg(OH)2]=n(Mg)=0.15mol,根据电子守恒,生成氢气的物质的量为:$\frac{0.2mol×3+0.15mol×2}{2}$=0.45mol,标况下0.45mol氢气的体积为:22.4L/mol×0.45mol=10.08L,由于没有告诉在标况下,则氢气的体积不一定为10.08L,故D错误;
故选C.
点评 本题考查了镁和铝的性质、离子方程式的计算,题目难度中等,能正确分析图象中各部分的反应及溶液中存在的溶质是解本题的关键,D为易错点,注意没有告诉在标准状况下.

| A. | 甲升高温度,乙不变 | B. | 甲中加入0.1molHe,乙不变 | ||
| C. | 甲、乙提高相同温度 | D. | 甲增加0.1molH2,乙不变 |
①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④托盘天平 ⑤50mL烧杯 ⑥10mL量筒 ⑦100mL量筒 ⑧滴定管.
| A. | ⑥③⑧⑤①② | B. | ⑥⑤③①⑧② | C. | ④⑤③②①⑧ | D. | ⑥②⑤①③② |
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | c (H+)=0.lmol•L-1的溶液中:Cu2+、A13+、SO42-、NO3- | |
| C. | 能使红色石蕊试纸变蓝的溶液中:K+、CO32-、NO3-、AlO2- | |
| D. | 在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42- |
| A. | 向100mL 0.1mol•L-1 FeBr2溶液中通入0.012mol Cl2:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl- | |
| B. | 少量的铁与稀硝酸反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O | |
| C. | 铜与氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 过量二氧化碳通入澄清石灰水:Ca2++2OH-+CO2═CaCO3↓+H2O |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 过氧化钠固体与水反应:2O22?+2H2O═4OH?+O2↑ | |
| B. | 氨水中通入过量二氧化硫:2NH3•H2O+SO2═2NH4++SO32?+H2O | |
| C. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH?+HCO3?═CaCO3↓+H2O | |
| D. | 将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:2Al3++7OH?═Al(OH)3↓+AlO2?+2H2O |
| A. | 氟化氢的电子式:H+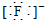 | B. | 氯原子的结构示意图: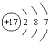 | ||
| C. | 乙酸的分子式:CH3COOH | D. | 1,2-二溴乙烷的结构简式:C2H4Br2 |
| A. | 所有的油脂都不能使溴水褪色 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 蔗糖、淀粉、油脂等都可以发生水解反应 | |
| D. | 食用纤维素、淀粉、蛋白质、植物油都是高分子化合物 |