题目内容
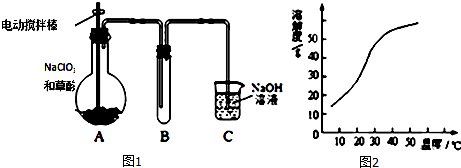
17.高铁酸钾(K2FeO4)是具有紫色光泽的粉末、它是一种集氧化、吸附、凝集、杀菌、除藻及新高型高效多功能于一体的水处理剂.其生产工艺如图1所示
已知:干燥的高铁酸钾在198℃是稳定的,受强热易分解变质
根据以上信息,请同答下列问题:
(1)高铁酸钾中铁元素化合价为+6;为防止高铁酸钾变质,应在低温、干燥 环境中保存
(2)反应a应在温度较低的情况下进行,因温度较高时,KOH与Cl2反应生成KClO3,写出在温度较高时KOH溶液与Cl2发生反应的离子方程式2OH-+Cl2=Cl-+ClO-+H2O.当反应中有2mol电子转移时,消耗的Cl2在标况下体积44.8L
(3)在溶液I中加入KOH固体的目的是A(填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
如何判定晶体已洗涤干净?取最后一次洗涤液,滴加硝酸酸化的硝酸银溶液,无白色沉淀生成
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程
式:4 FeO42-+10 H2O=4 Fe(OH)3(胶体)+3O2↑+8OH-.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示.电解过程中阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH?3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为Zn-2e-+2OH-=Zn(OH)2.
分析 足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4;
(1)高铁酸钾中K为+1价,氧元素为-2价,可结合正负化合价代数和为0,来判断铁元素的化合价,干燥的高铁酸钾在198℃是稳定的,受强热易分解变质,可结合此性质确定保存环境;
(2)低温下氯气与KOH溶液反应生成KCl和KClO及水,据此可写出此反应的化学方程式,再改写成离子方程式,此反应中氯气发生歧化反应,每消耗一个氯分子转移1个电子;
(3)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;晶体表面附着的溶液里有KCl,只要检验一下洗涤液里有无Cl-,就可以了;
(4)此反应中铁元素的化合价从+6降为+3价,氧元素有-2价升高为0价,可结合电子守恒、电荷守恒和原子守恒来配平离子方程式;
(5)电解池中阳极发生氧化反应,并结合产物是高铁酸钾和氧化还原反应理论写出阳极电极反应式;
(6)放电时总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,锌被氧化为,是原电池的负极,据此可写出负极电极反应式.
解答 解:(1)根据正负化合价代数和为0,并结合钾和氧元素的化合价,可计算出铁的化合价为[-(-2)×4+(+1)×2]=+6价,因高铁酸钾在高温下易分解,因此选择干燥低温环境保护,故答案为:+6;低温、干燥;
(2)氯气与KOH在低温下反应的化学方程式为2KOH+Cl2=KCl+KClO+H2O,相应的离子反应方程式为2OH-+Cl2=Cl-+ClO-+H2O,当反应中有2mol电子转移时,消耗的Cl2的物质的量为2mol,在标况下体积为2mol×22.4L/mol=44.8L,故答案为:2OH-+Cl2=Cl-+ClO-+H2O;44.8L;
(3)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应生成KClO,检验晶体洗涤干净的方法是取最后一次洗涤液,滴加硝酸酸化的硝酸银溶液,无白色沉淀生成,即可证明洗涤干净,
故答案为:A;取最后一次洗涤液,滴加硝酸酸化的硝酸银溶液,无白色沉淀生成;
(4)反应中铁除3价,每生成一个氧气升高4价,最小公倍数为12,故高铁酸根离子前系数为4,氧气前系数为3,为满足电荷守恒,OH-前的系数为8,再借助原子守恒进行配平即得到离子反应式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:4、10、4、3、8;
(5)电解池的阳极反应氧化反应,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
(6)从放电时总反应式可知负极电极反应式为Zn-2e-+2OH-=Zn(OH)2,故答案为:Zn-2e-+2OH-=Zn(OH)2.
点评 本题考查较为综合,涉及氧化还原反应、离子方程式的书写、电化学理论、化学平衡移动等问题,题目难度中等,本题注意从质量守恒的角度分析.

| A. | 在指定状态下各物质的焓值都是确定且是唯一的 | |
| B. | 当同一个化学反应以不同的过程完成时,反应的焓变是不同的 | |
| C. | 如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变为相关化学反应的焓变的代数和 | |
| D. | 对于一个化学反应,无论经过哪些步骤从反应物变成生成物,反应的焓变是一样的 |
| A. | 原混合气体的体积为1.2V L | B. | 原混合气体的体积为1.1V L | ||
| C. | 反应达平衡时气体A消耗掉0.05V L | D. | 反应达平衡时气体B消耗掉0.05V L |
| A. | 野火烧不尽,春风吹又生 | B. | 春蚕到死丝方尽,蜡炬成灰泪始干 | ||
| C. | 爆竹声中一岁除,春风送暖入屠苏 | D. | 粉身碎骨浑不怕,要留清自在人间 |
| A. | H2SO4→SO2 | B. | Zn2+→Zn | C. | H2O→H2 | D. | CuO→CuCl2 |


 B(OH)4-+H+;
B(OH)4-+H+;